
自2012年CRISPR-Cas9系统被确立为可编程的基因编辑工具以来,这项革命性技术已深刻重塑了生命科学研究的格局,并以前所未有的速度向临床应用迈进。然而,早期的CRISPR-Cas9依赖于在目标DNA位点制造双链断裂(DSB),这一机制虽强大,却也伴随着脱靶效应、染色体易位等潜在基因毒性风险,限制了其在某些敏感细胞类型(如造血干细胞)中的安全应用。
如今,一篇发表于《细胞报告医学》(Cell Reports Medicine)的权威综述《基因与细胞疗法的新兴趋势:CRISPR在DNA编辑及其超越》为我们描绘了一幅更为广阔和精细的CRISPR技术全景图。该综述指出,CRISPR领域正经历一场深刻的范式转变——从最初的“分子剪刀”进化为一套功能多样的“分子机器”,其能力已远远超越简单的DNA切割,延伸至碱基编辑、先导编辑乃至表观基因组和转录组的精准调控。
碱基编辑(Base Editing):无痕修正单个字母
作为对传统CRISPR-Cas9局限性的直接回应,碱基编辑技术应运而生。它巧妙地将催化失活的Cas蛋白(如dCas9或nCas9)与特定的脱氨酶融合,能够在不产生DSB的情况下,直接、高效地实现C•T或A•G之间的碱基转换。自2016年David Liu团队开创性工作以来,碱基编辑器经历了多轮优化,其效率、特异性和编辑窗口都得到了显著提升。例如,通过融合单链DNA结合蛋白结构域,研究人员成功拓宽了胞嘧啶碱基编辑器的靶向范围;而新型的腺嘌呤颠换编辑器(AXBEs)甚至能实现A•T到C•G的精准颠换,极大地扩展了可治疗的遗传病突变谱。然而,近期研究(如Fiumara等人,2024)也警示我们,即使在不产生DSB的情况下,碱基编辑在人类造血干细胞中仍可能引发意想不到的基因毒性效应,这凸显了在推进临床转化前进行彻底安全性评估的极端重要性。
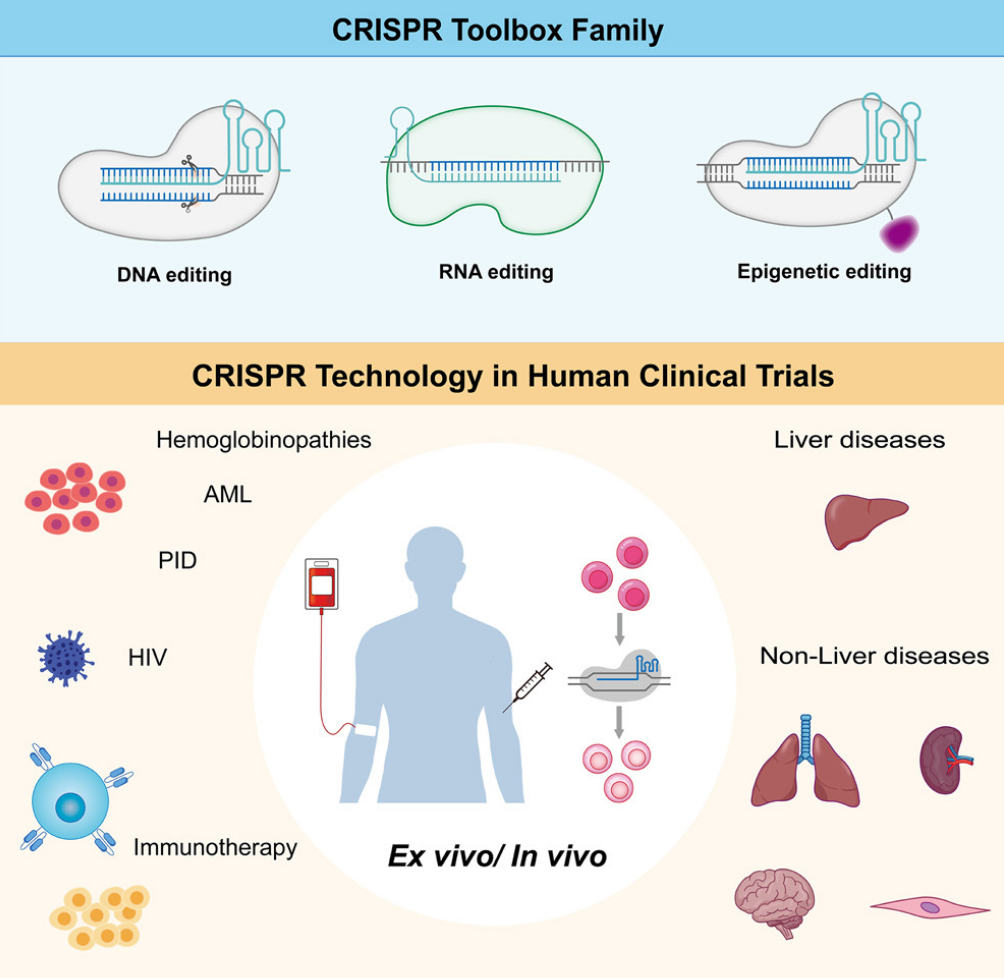
先导编辑(Prime Editing):搜索-替换式的精准修复
如果说碱基编辑是“修正笔”,那么先导编辑则堪称“文字处理器”。由Anzalone等人于2019年发明的先导编辑技术,通过融合nCas9与逆转录酶,并利用一种特殊的先导编辑向导RNA(pegRNA),能够实现所有12种碱基转换、小片段插入和删除,且几乎不产生DSB。这一“搜索-替换”式的编辑模式为纠正高达90%的已知致病性点突变提供了前所未有的可能性。近年来,该技术持续迭代升级:双向引物启动的Bi-PE系统提高了编辑效率;twin prime editing策略则实现了对大片段DNA序列的可编程删除、替换、整合与倒位。更重要的是,研究者们正通过操纵细胞内的DNA修复通路、开发更紧凑高效的先导编辑器(如通过噬菌体辅助进化获得的变体),以及利用AI设计的小分子结合蛋白(如Park等人,2025年针对MLH1的结合剂)来进一步提升其在原代细胞中的效率和保真度。
超越DNA:迈向表观基因组与转录组编辑
CRISPR的潜力远不止于改变DNA序列本身。通过将dCas9与各种表观修饰酶(如甲基转移酶、乙酰化酶)或转录激活/抑制结构域融合,科学家们已经能够对基因组进行“软件层面”的重编程。这种表观基因组编辑和转录组编辑技术,可以在不改变底层遗传密码的前提下,持久地开启或关闭特定基因的表达。这种方法为治疗由基因剂量异常(如单倍体不足)或复杂多基因疾病(如神经退行性疾病、代谢综合征)引起的病症开辟了全新路径,规避了永久性DNA改变所带来的长期安全顾虑。
挑战与未来:通往安全有效的临床转化
尽管CRISPR工具箱日益丰富,但通往广泛应用的道路依然充满挑战。脱靶效应、递送效率、免疫原性以及不同细胞类型对编辑的响应差异,都是必须克服的障碍。特别是对于需要终身治愈效果的遗传病,确保编辑事件发生在正确的细胞(如长期造血干细胞)并维持其干性至关重要。此外,新兴的TOPO-seq等技术揭示了DNA拓扑结构对Cas9和碱基编辑器脱靶活性的影响,这为未来设计更安全的编辑器提供了新的考量维度。
CRISPR技术正从一个单一的基因敲除工具,演变为一个集精准DNA编辑、表观调控和转录干预于一体的综合性平台。随着对这些工具的安全性、效率和递送方式的持续优化,我们有理由相信,一个由CRISPR驱动的、更加个性化和高效的基因与细胞疗法新时代正在加速到来。