
嵌合抗原受体T细胞(CAR-T)疗法作为革命性的“活体药物”,已在血液系统恶性肿瘤治疗中取得了令人瞩目的成功。然而,其临床应用仍面临诸多挑战,其中瞬时性(transience)和安全性是两大核心瓶颈。传统的基于病毒载体的CAR-T细胞可实现长期存续,但存在插入突变风险;而基于线性mRNA(linear mRNA)的非病毒方法虽安全性高,却因mRNA在细胞内快速降解而导致CAR表达时间过短,疗效有限。
近日,一项发表于《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy)的重磅研究,为解决这一困境提供了创新方案。该研究团队开发了一种名为Hi-Scarless-PIE的新型环化策略,成功合成了无痕环状mRNA(scarless circular mRNA, cmRNA),并将其应用于CAR-T细胞的制备。研究结果表明,这种cmCAR-T细胞不仅展现出远超线性mRNA CAR-T(mCAR-T)的持久性和强大细胞杀伤活性,而且在体内模型中实现了更优的肿瘤清除效果和更高的安全性,为下一代CAR-T疗法的开发开辟了新路径。
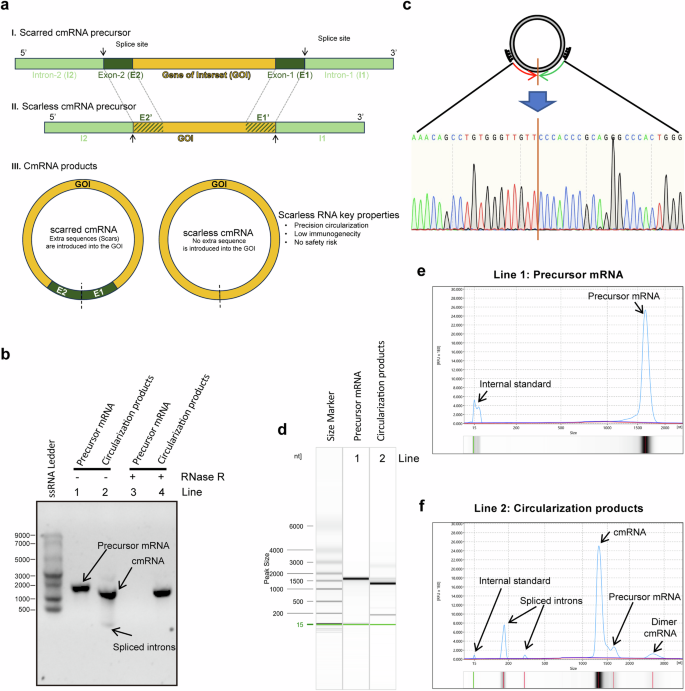
突破性技术:Hi-Scarless-PIE实现精准无痕环化
环状RNA(circRNA)因其独特的闭合环状结构,天然具有抵抗外切酶降解的能力,理论上可提供比线性mRNA更持久的蛋白表达。然而,传统的环化方法(如经典的PIE策略)会在环化连接处留下额外的氨基酸序列(即“疤痕”),这可能干扰所编码蛋白(如CAR)的功能和稳定性。
本研究的核心创新在于开发了Hi-Scarless-PIE(High-efficiency Scarless Permuted Intron Exon)技术。该策略通过工程化改造自剪接内含子,实现了在环化后精确移除所有非模板序列,从而生成在连接处序列完全正确的“无痕”cmRNA。研究人员通过RNase R抗性实验、Sanger测序和毛细管电泳等多种方法,证实了该方法能高效(>90%)、精准地合成目标cmRNA,为后续功能研究奠定了坚实基础。
体外验证:cmCAR-T细胞展现持久且强大的细胞毒性
研究团队分别构建了靶向CD19(用于B细胞恶性肿瘤)和GPRC5D(用于多发性骨髓瘤)的cmCAR-T和mCAR-T细胞,并进行了系统的体外功能评估。
结果显示,在转染后的第1天,无论是cmCAR-T还是mCAR-T,均能高效、特异性地裂解其对应的阳性肿瘤细胞(如NALM-6、Raji或MM.1S、RPMI-8226),而对阴性对照细胞(K562)则无影响,证明了其靶向特异性。
关键差异出现在持久性上。到了转染后的第4天,mCAR-T细胞的细胞毒性已显著下降——其对NALM-6细胞的杀伤效率降至40-60%,甚至对Raji细胞完全丧失了可测量的杀伤能力。相比之下,cmCAR-T细胞在整个观察期内均维持了接近完全的肿瘤细胞裂解能力。这一结果清晰地证明,无痕cmRNA能够驱动CAR蛋白的长期、稳定表达,从而赋予T细胞持久的抗肿瘤活性。
此外,细胞因子释放分析显示,cmCAR-T细胞在激活后能分泌高水平的IFN-γ、TNF-α和IL-2,其免疫激活状态与mCAR-T相当,进一步佐证了其功能完整性。
体内疗效:cmCAR-T实现更彻底的肿瘤清除
为了评估其在体内的治疗潜力,研究团队建立了小鼠肿瘤模型。接受cmCAR-T细胞治疗的小鼠,其肿瘤生长得到了更为显著和持久的抑制。与接受mCAR-T治疗的小鼠相比,cmCAR-T治疗组的小鼠表现出更低的肿瘤负荷和更长的生存期。这些数据有力地证明,由无痕cmRNA驱动的CAR-T细胞在复杂的体内环境中同样能发挥出优越的抗肿瘤效力。
安全性优势:规避基因组整合风险
除了卓越的疗效,该技术的安全性也是一大亮点。由于cmRNA完全在细胞质中发挥作用,不进入细胞核,因此从根本上规避了病毒载体介导的基因组随机整合所带来的潜在致癌风险。同时,其瞬时表达的特性(尽管比线性mRNA持久得多)也为控制潜在的细胞因子风暴等副作用提供了安全窗口。这种“高效、持久、安全”的三重优势,使得cmCAR-T疗法在临床转化上极具吸引力。
展望
这项研究成功地将前沿的RNA环化技术与成熟的CAR-T平台相结合,创造出一种性能显著提升的新一代细胞疗法。Hi-Scarless-PIE技术不仅解决了传统环化mRNA的“疤痕”问题,还充分发挥了环状RNA的稳定性优势。cmCAR-T细胞在体内外均展现出优于现有mCAR-T的持久性、有效性和安全性,为治疗复发/难治性血液肿瘤乃至未来拓展至实体瘤领域提供了强大的技术支撑。
随着RNA疗法领域的飞速发展,这种基于无痕环状mRNA的策略有望成为下一代细胞和基因治疗产品的核心引擎,为更多患者带来希望。