行业动态

在病毒的世界里,生存是一场永不停歇的军备竞赛。为了在宿主强大的免疫防御下存活并繁衍,病毒进化出了各种精妙的策略。冠状病毒,作为拥有已知最大RNA基因组的病毒家族,其成功秘诀不仅在于快速突变,更在于一种被称为“RNA重组”的高阶技能——它们能像编辑视频一样,剪切、拼接自己的遗传物质,从而产生新的变体,实现免疫逃逸或适应新环境。
然而,这场“自我编辑”的游戏并非毫无章法。近期,一项发表于顶级期刊《Nature Communications》的重磅研究(Zhou et al., Nat Commun 2025)揭示了一个关键角色:病毒自身携带的一把“分子剪刀”——非结构蛋白15(NSP15)。这项研究不仅阐明了NSP15如何像一位精明的“交通警察”一样,精细调控着病毒RNA重组的不同路径,还意外地发现,这把剪刀的失灵,竟会引发一场“杀敌一千,自损八百”的免疫风暴。这一发现为我们理解病毒致病机制、开发新型抗病毒药物提供了全新的视角。
一、SARS-CoV-2:一位天赋异禀的“重组大师”
研究团队首先对包括SARS-CoV-2在内的四种人类冠状病毒(HCoVs)进行了深入的RNA测序分析。结果令人惊讶:与其他常见的冠状病毒(如引起普通感冒的HCoV-OC43和HCoV-229E,以及致命的MERS-CoV)相比,SARS-CoV-2展现出显著更高的RNA重组频率,其重组事件的发生率高出近1.8倍。
更有趣的是,无论在哪种冠状病毒中,这些重组事件都高度偏好发生在富含尿嘧啶(Uridine, U)的RNA序列区域。想象一下,病毒的基因组就像一条由A、U、C、G四种字母组成的长链,而重组的“剪切点”总是出现在一连串“U”字母附近。这一普遍规律强烈暗示,病毒体内必然存在一种专门识别并切割“U”序列的工具。
这个工具,正是NSP15。作为一种内切核糖核酸酶(EndoU),NSP15的功能就是精准地在尿嘧啶位点切断RNA链。过去的研究认为,NSP15的主要作用是“清理战场”——通过降解病毒在复制过程中产生的异常双链RNA(dsRNA),来避免被宿主细胞的“哨兵”(如MDA5、RIG-I等模式识别受体)发现,从而抑制I型干扰素(IFN)的产生,帮助病毒逃避免疫监视。
二、失灵的“剪刀”:病毒变弱了,但疾病却没减轻?
为了探究NSP15在RNA重组中的具体作用,研究人员构建了一个关键突变体——NSP15-H234A。在这个突变体中,NSP15的催化活性被完全废除,相当于让这把“分子剪刀”彻底钝化。
不出所料,在实验室的细胞模型(尤其是具有完整干扰素反应的人源呼吸道细胞Calu-3)中,NSP15-H234A病毒的复制能力明显减弱。当用干扰素预处理细胞后,突变病毒的复制更是受到了毁灭性打击,其敏感度远高于野生型病毒。这再次证实了NSP15在对抗宿主先天免疫中的核心地位。
然而,真正的惊喜出现在活体动物实验中。研究者使用金黄叙利亚仓鼠这一经典的新冠感染模型,分别用野生型病毒和NSP15-H234A突变病毒感染。结果令人费解:尽管突变病毒在仓鼠肺部的载量显著降低,但感染仓鼠的体重下降程度和临床疾病症状,却与野生型病毒感染组几乎完全相同!
为什么病毒变少了,疾病却一点没轻?答案藏在宿主的免疫反应里。
三、双刃剑效应:从免疫逃逸到免疫风暴
通过对感染仓鼠肺部组织进行深度转录组测序,研究人员揭开了谜底。在感染早期(第2天),NSP15-H234A突变病毒感染的仓鼠肺部,呈现出一种极其强烈的、失调的免疫反应。
一方面,由于NSP15失活,病毒无法有效清除其异常RNA,导致大量免疫刺激性RNA(包括dsRNA和缺陷病毒基因组DVGs)堆积。这极大地激活了宿主的抗病毒通路,I型和III型干扰素(Ifnb1, Ifnl3)及其下游的干扰素刺激基因(ISGs,如Rsad2, Mx1, Isg15)的表达水平急剧飙升。这种强大的抗病毒状态成功地压制了病毒复制。
但另一方面,这场免疫反应“用力过猛”了。除了抗病毒因子,大量促炎细胞因子(如Cxcl10, Ccl5)和炎症相关基因(如Tnfaip6, Il1rn)也被同步、甚至过度地激活。病理学检查证实,尽管病毒载量低,但突变病毒感染的仓鼠肺部依然出现了与野生型感染组同等严重的免疫细胞浸润、支气管炎、间质性肺炎和血管炎。简而言之,宿主的免疫系统在成功控制病毒的同时,也对自身组织造成了严重的“附带损伤”。
这完美诠释了NSP15作为一把“双刃剑”的本质:它既能帮助病毒逃避免疫清除,又能防止免疫反应失控。一旦这把剑失灵,病毒虽弱,却可能因引发剧烈的炎症而维持其致病性。
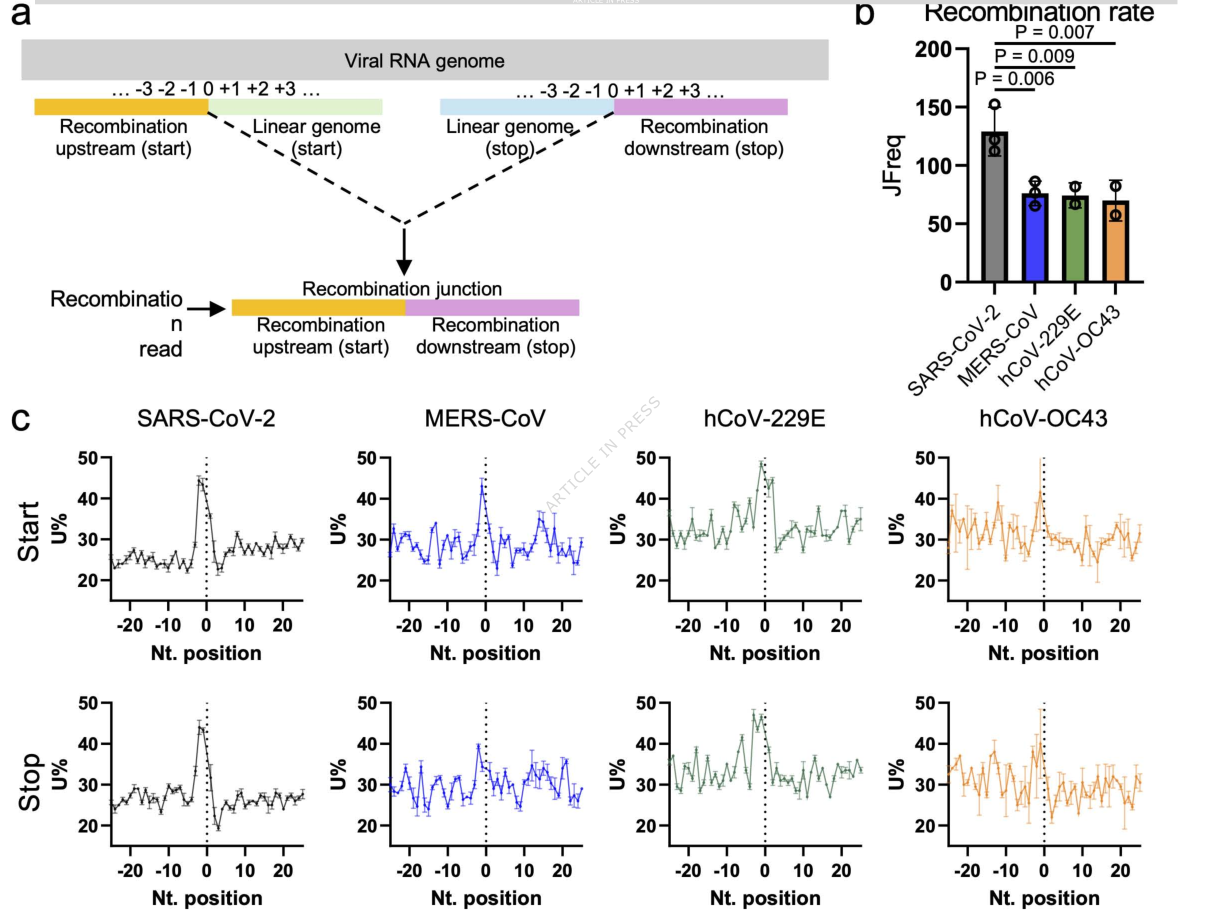
四、NSP15:RNA重组的“精密调度员”
那么,NSP15是如何影响RNA重组的呢?研究给出了一个颠覆性的答案。人们曾猜测,NSP15的切割活动可能会为重组提供模板,从而促进重组。但事实恰恰相反。
在NSP15失活的突变病毒中,整体的RNA重组事件反而增加了!然而,这种增加并非均匀分布。研究发现,NSP15扮演着一个“精密调度员”的角色:
促进有益重组:它正向调控了冠状病毒生命周期中至关重要的亚基因组mRNA(sgmRNA)的生成。sgmRNA是病毒用来高效翻译其结构蛋白(如刺突蛋白S、核衣壳蛋白N)的信使。NSP15-H234A突变体的sgmRNA产量显著下降,这直接解释了其复制能力的减弱。
抑制有害重组:它负向调控了那些会产生缺陷病毒基因组(DVGs)的重组事件,如大片段缺失和微缺失。在突变体中,这类错误的重组事件大量涌现,产生了更多具有强免疫刺激性的DVGs,成为点燃免疫风暴的“火药桶”。
在体外培养的细胞和纯化的病毒颗粒中,这种现象清晰可见。而在体内,情况则更为复杂。由于宿主强大的选择压力,虽然突变病毒产生的DVGs种类减少了,但某些特定的、可能具有适应性优势的DVGs却被强烈地筛选出来,并在病毒群体中占据主导地位。
五、启示与展望:靶向NSP15的机遇与挑战
这项研究带来的启示是深远的。首先,它解释了为何SARS-CoV-2比其他冠状病毒更具进化潜力——其独特的NSP15活性可能在平衡sgmRNA生成与DVGs抑制之间找到了一个“最佳点”,既保证了高效的复制,又维持了足够的遗传多样性以应对选择压力。
其次,对于药物开发而言,NSP15无疑是一个极具吸引力的靶点。抑制其活性可以削弱病毒复制并增强宿主的抗病毒免疫。然而,这项研究也敲响了警钟: 盲目抑制NSP15可能会引发过度的炎症反应,导致与病毒载量不相称的组织损伤,这在临床上可能是危险的。
因此,未来的药物设计需要更加精细。理想的情况是,开发出能够特异性阻断NSP15免疫逃逸功能,但不影响其调控sgmRNA生成的化合物;或者,在使用NSP15抑制剂的同时,辅以适当的抗炎治疗,以平衡免疫反应。
总而言之,这项研究将NSP15从一个单纯的“免疫逃避者”重新定义为病毒生命周期和宿主-病毒互作网络中的“中央协调者”。它深刻地提醒我们,在与病毒的斗争中,不仅要关注如何杀死病毒,更要理解病毒与我们自身免疫系统之间那微妙而复杂的博弈。只有这样,我们才能开发出真正安全有效的下一代抗病毒疗法。
声明:本网所有转载文章内容为了宣传行业动态所用,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。

