
乙型肝炎病毒(HBV)感染是全球性的重大公共卫生挑战,影响着超过2.5亿人。尽管现有核苷(酸)类似物(NAs)能有效抑制病毒复制,但它们无法清除病毒的“生命中枢”——共价闭合环状DNA(cccDNA),因此患者通常需要终身服药。而干扰素疗法虽能提供有限的“功能性治愈”(即停药后持续的HBsAg清除和HBV DNA检测不到),但其疗效有限且副作用显著。
近年来,以RNA干扰(RNAi)和反义寡核苷酸(ASO)为代表的基因沉默疗法,因其能直接靶向并降解病毒mRNA,从而强力抑制所有病毒蛋白(包括HBsAg)的产生,被视为实现乙肝功能性治愈的关键路径。然而,单一机制的疗法往往难以彻底清除病毒库。现在,一项发表于《Nature Communications》的最新研究(Liu et al., Nat Commun 2025)带来了一个令人振奋的消息:一种名为KC13-M2G2的新型双特异性寡核苷酸药物,在临床前模型中展现出了超越现有疗法的卓越效力,有望成为乙肝治疗领域的一匹黑马。
一、KC13-M2G2:集两大“神技”于一身的创新分子
KC13-M2G2并非简单的两种药物混合,而是一个经过精密设计的单一分子实体。它巧妙地将两种强大的抗病毒机制融合在一起:
RNA干扰(RNAi) 这部分功能类似于已进入后期临床试验的药物Elebsiran(JNJ-3989),能够高效、持久地沉默HBV的所有mRNA转录本,从而深度降低HBsAg、HBeAg和HBV DNA。
免疫刺激(TLR8激动剂) 分子的另一端则连接了一个Toll样受体8(TLR8)激动剂。TLR8是存在于免疫细胞(如单核细胞、树突状细胞)内体中的一种模式识别受体。激活TLR8可以触发强烈的先天免疫反应,释放多种促炎细胞因子(如IL-12, TNF-α),进而激活适应性免疫系统,特别是细胞毒性T淋巴细胞(CTLs),这对于最终清除被感染的肝细胞至关重要。
这种“一石二鸟”的设计思路,旨在同时解决乙肝治愈的两大核心难题:深度抑制病毒抗原(尤其是HBsAg,它是免疫耐受的关键)。
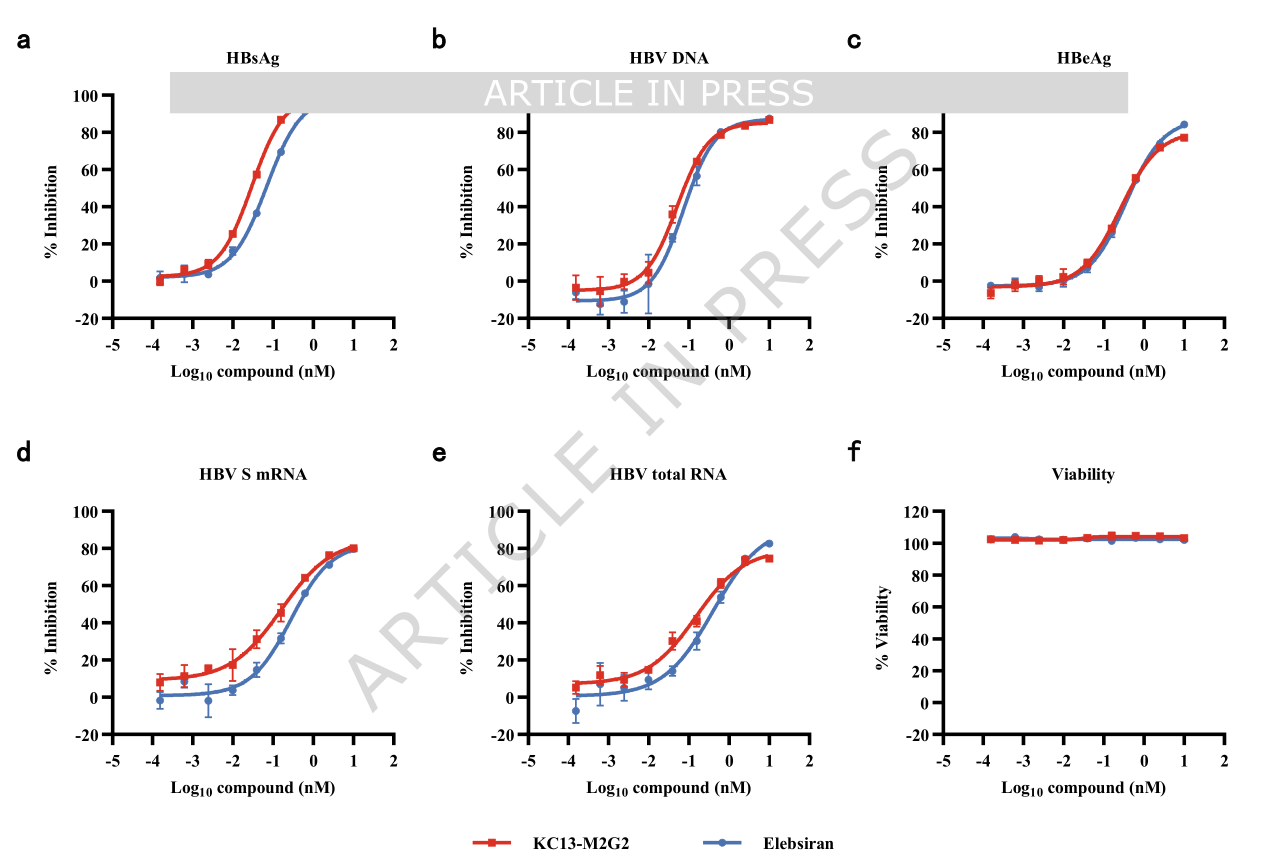
二、临床前数据亮眼:全面超越现有疗法
研究团队在表达HBV的人源化肝脏小鼠模型(rAAV-HBV-D mice)中,对KC13-M2G2进行了严格的评估,并将其与当前领先的疗法进行头对头比较,包括:
Elebsiran(3 mg/kg, QWx3):代表新一代RNAi疗法。
Bepirovirsen(22 mg/kg, BIWx1+QWx3):代表先进的ASO疗法。
恩替卡韦(ETV, 0.1 mg/kg, daily):代表标准NAs疗法。
结果令人印象深刻:
HBsAg清除: KC13-M2G2在所有测试剂量(0.1, 0.3, 1, 3 mg/kg)下均实现了快速且深度的HBsAg下降。在最高剂量(3 mg/kg)下,其效果不仅优于Elebsiran,甚至达到了与Bepirovirsen相当的水平。更重要的是,在一个独立的实验中,KC13-M2G2成功诱导了抗-HBs抗体(HBsAb)的产生,这标志着宿主免疫系统已被成功唤醒,开始主动对抗病毒,这是走向功能性治愈的关键一步。
HBV DNA与HBeAg抑制: KC13-M2G2同样展现出对HBV DNA和HBeAg的强大抑制能力,效果优于或等同于对照药物。
安全性: 研究监测了血浆ALT(丙氨酸氨基转移酶)水平作为肝损伤的指标。结果显示,KC13-M2G2治疗并未引起显著的ALT升高,表明其具有良好的肝脏安全性。组织病理学分析也证实,该药物主要引起预期的、与TLR8激活相关的免疫细胞(如泡沫状巨噬细胞)在淋巴结的聚集,而未观察到严重的肝毒性。
三、“双引擎”驱动:协同效应是成功的关键
KC13-M2G2的成功并非两种机制的简单叠加,而是产生了强大的协同效应(Synergy)。
RNAi先行,破除免疫耐受: 首先,RNAi部分强力压制了HBsAg的水平。高浓度的HBsAg是导致T细胞耗竭和免疫耐受的罪魁祸首。通过大幅降低这一“免疫屏障”,为后续的免疫激活扫清了道路。
TLR8激活,点燃免疫之火: 在病毒抗原压力减轻后,TLR8激动剂适时激活先天免疫系统。被激活的抗原呈递细胞能够更有效地处理和呈递残留的病毒抗原,从而成功启动和扩增针对HBV的特异性T细胞和B细胞反应。
形成正向循环: 激活的免疫系统不仅能进一步清除病毒,还能产生抗-HBs抗体,提供长期的免疫保护,防止病毒反弹。
这种“先抑后扬”的策略,完美模拟了理想的功能性治愈过程:先用药物强力压制病毒,再用免疫疗法巩固战果并建立长期免疫记忆。
四、行业启示:为乙肝治愈组合疗法指明新方向
这项研究的意义远不止于KC13-M2G2本身。它为整个乙肝治愈领域提供了重要的概念验证:
双特异性/多功能分子是未来趋势: 将直接抗病毒作用与免疫调节功能整合到一个分子中,可以简化治疗方案(单药 vs 联合用药),提高患者依从性,并可能通过内在的协同作用获得更优的疗效。
TLR激动剂的价值重获关注: 尽管早期TLR激动剂因全身性炎症毒性而受挫,但通过与靶向递送系统(如GalNAc,可将药物精准送达肝细胞)或像KC13-M2G2这样的局部作用设计相结合,可以有效控制其活性范围,最大化疗效的同时最小化副作用。
HBsAg清除与抗-HBs血清学转换是核心目标: KC13-M2G2能够诱导抗-HBs的产生,这一终点指标比单纯的HBsAg下降更具临床意义,因为它预示着持久的免疫控制。
当然,KC13-M2G2目前仍处于临床前阶段。其在人体中的安全性、耐受性和有效性仍有待I期临床试验的验证。特别是TLR8激活带来的潜在细胞因子释放风险,需要在临床中被密切监控。
结语
从“终身服药”到“一次治愈”,乙肝治疗的范式正在发生深刻变革。KC13-M2G2这类创新的双特异性寡核苷酸药物,以其独特的“抗病毒+免疫激活”双重机制,为我们描绘了一幅充满希望的蓝图。它不仅是药物化学的一次精妙杰作,更是向乙肝功能性治愈这一终极目标迈出的坚实一步。我们有理由期待,随着更多此类创新疗法的涌现,乙肝患者的“治愈梦”终将照进现实。