行业动态

在生物制药产业的剧烈变革中,一类技术正以惊人的速度从实验室走向临床,重塑我们对抗疾病的武器库:精准基因编辑驱动的细胞疗法。这不是渐进式改进,而是一场范式革命——科学家们不再满足于简单地"给予"患者药物,而是直接重编程人体自身的细胞,将其转化为高度特异性的治疗载体。从癌症到遗传病,从免疫缺陷到衰老相关疾病,这一领域正以前所未有的速度突破传统治疗边界。本文将深入探讨当前细胞疗法产业的技术突破、产业化挑战及商业前景,为行业从业者提供战略思考。
基因编辑:细胞疗法精准化的关键催化剂
长久以来,细胞疗法面临精确性与可控性的双重挑战。传统细胞治疗手段如骨髓移植或早期CAR-T技术,往往缺乏分子级别的精准控制,导致疗效不稳定和安全性问题。而基因编辑技术的突破,特别是TALEN和CRISPR系统的成熟,为细胞治疗带来了革命性转变。
近期发表在《自然·通讯》上的突破性研究展示了这一领域的最新进展。研究人员成功利用TALEN基因编辑技术改造通用型CAR-T细胞,赋予其免疫逃逸特性,解决了异体细胞治疗中的排斥反应难题。这种"隐形"CAR-T细胞在临床前模型中展现出卓越的持久性和抗肿瘤活性,为实现"现货型"细胞治疗产品铺平了道路。
"过去十年,我们见证了基因编辑从实验室工具到药物开发平台的转变,"某国际生物制药企业首席科学官表示,"如今,精确到单碱基的编辑能力使我们能够像编程软件一样编程细胞,这是医药史上前所未有的精准度。"
值得注意的是,这种精准编辑能力正迅速扩展到造血干细胞领域。最新研究表明,通过优化的两步电穿孔工艺,科学家已能实现原代T细胞中高达65%的非病毒介导基因插入效率。这对于大规模生产治疗用细胞产品具有里程碑意义,解决了病毒载体生产周期长、成本高的产业化瓶颈。
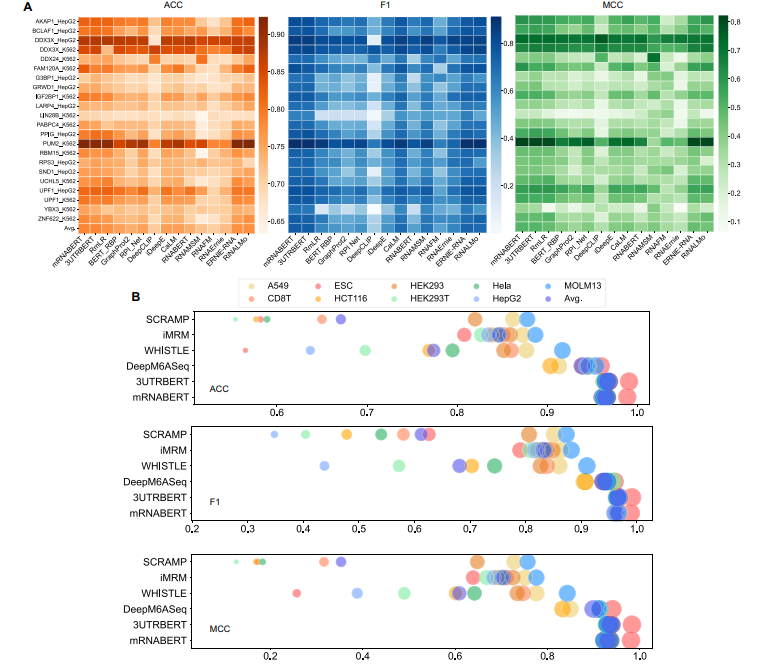
造血干细胞:再生医学的"万能钥匙"正在被精准复制
造血干细胞(HSCs)作为再生医学的"圣杯",其临床应用长期受限于体外扩增困难和干性维持挑战。然而,多组学技术与基因编辑的结合正迅速改变这一局面。
在《自然·免疫学》最新发表的研究中,科学家们构建了人类造血祖细胞的免疫表型耦合转录组图谱,以前所未有的分辨率揭示了造血干细胞分化的分子路径。这一突破不仅深化了我们对血液系统发育的理解,更为精准调控干细胞命运提供了分子指南针。
更令人振奋的是,研究者发现HLF(肝白血病因子)的表达定义了人类造血干细胞的功能状态。这一生物标志物的鉴定为干细胞产品的质量控制提供了关键指标,有望解决细胞治疗产品批次间差异大的行业痛点。
"过去,我们像是在黑暗中摸索干细胞的特性,"一位顶尖血液学研究所的负责人解释道,"现在,多组学技术和单细胞分析让我们第一次看清了造血系统的'地图',可以有目的地引导干细胞向特定谱系分化,这是再生医学的重大跃进。"
最新的体外扩增技术同样令人瞩目。科学家已鉴定出整合素-α3作为体外扩增的人类长期造血干细胞的功能标志物。通过靶向这一分子,研究人员成功实现了功能性造血干细胞的规模化扩增,为血液疾病治疗提供了更可靠的细胞来源。
产业化挑战:从实验室奇迹到可及疗法
尽管科学突破令人振奋,细胞疗法的产业化仍面临严峻挑战。生产成本、质量控制、物流配送和监管框架构成了这一领域的"四重壁垒"。
以通用型CAR-T为例,尽管TALEN编辑技术解决了免疫排斥问题,但大规模生产依然面临挑战。当前,一个患者剂量的自体CAR-T细胞生产成本在30-50万美元之间,而实现"现货型"产品需要将成本降至十分之一才能具备广泛可及性。产业界正通过自动化封闭式生产系统、非病毒基因递送技术和冻存即用型产品设计来破解这一难题。
在造血干细胞领域,体外扩增的临床转化同样任重道远。尽管实验室中已实现功能性造血干细胞的扩增,但如何在GMP条件下规模化生产,同时确保基因组稳定性,仍是亟待解决的问题。某细胞治疗CDMO企业高管坦言:"我们面临的最大挑战是如何将学术界的尖端发现转化为可重复、符合监管要求的生产工艺,这需要工程学思维与生物学洞见的深度融合。"
质量控制是另一关键挑战。传统细胞产品检测方法往往耗时且不全面。基于单细胞技术的新型分析平台,如Symphony,正在改变这一局面。这种高效精准的单细胞参考图谱映射技术,可在24小时内完成对细胞产品全面质量评估,为生产过程中的实时决策提供依据。
商业模式创新:细胞疗法的价值重构
面对高昂的前期研发成本和复杂的生产挑战,细胞疗法企业正探索多元化的商业模式。
一种趋势是"平台技术授权+里程碑付款"模式。拥有核心基因编辑技术的企业通过向大型制药公司授权平台,获取前期付款和后续销售分成。这种模式降低了单一产品开发风险,加速了技术转化。2023年,全球细胞疗法领域技术授权交易总额超过120亿美元,较五年前增长300%。
另一种创新是"细胞即服务"(Cells-as-a-Service)模式。企业不直接销售细胞产品,而是提供细胞制造、基因编辑和质量控制的全流程服务。这种模式降低了客户的技术门槛,同时创造了持续性收入流。目前已有多家CDMO企业布局这一领域,年复合增长率达28%。
"细胞疗法的商业成功不仅取决于科学突破,更依赖于价值链重构,"一位生物医药投资合伙人指出,"未来五年,我们将看到更多跨价值链整合的商业模式,从基因编辑工具到细胞递送系统,形成完整的治疗解决方案。"
监管与伦理:平衡创新与安全
随着技术快速发展,监管框架也在持续演进。FDA的再生医学先进疗法(RMAT)认定和EMA的PRIME计划,为有前景的细胞疗法提供了加速审批通道。然而,基因编辑细胞的长期安全性评估、脱靶效应监测和患者随访体系仍需完善。
在伦理层面,体细胞编辑与生殖细胞编辑的界限需要明确界定。行业共识是,当前技术应专注于体细胞治疗,避免可遗传的基因组改变。同时,细胞治疗产品的可及性和公平分配也引发广泛讨论。如何在保护知识产权与确保全球患者可及性之间取得平衡,是产业界需要共同面对的挑战。
未来展望:2025-2030产业路线图
基于当前技术发展趋势和产业化进程,我们预见以下关键发展方向:
自动化与封闭式生产系统:到2027年,80%的细胞治疗产品将通过全自动、封闭式系统生产,大幅降低污染风险和人工成本
AI驱动的细胞设计:机器学习算法将整合多组学数据,预测最优基因编辑位点和细胞表型,实现"数字孪生"指导的细胞产品设计
体内细胞重编程:无需体外操作,通过靶向递送系统直接在患者体内重编程细胞,简化治疗流程
多细胞协同治疗:不同工程化细胞类型的组合使用,模拟天然免疫系统的协同作用,提高治疗效果
全球可及性突破:冻干技术和常温稳定配方将解决细胞产品的冷链依赖,使发展中国家患者也能受益
企业战略建议:抓住细胞编程革命
对于希望在这一浪潮中占据先机的企业,我们提出以下战略建议:
技术平台化:超越单一产品思维,构建可应用于多种疾病的基因编辑和细胞工程平台
垂直整合:战略性收购或合作,整合从基因编辑工具到细胞制造的全价值链能力
真实世界证据:投资真实世界数据收集和分析,建立超越传统临床试验的疗效和安全性证明体系
监管先行:早期与监管机构建立对话,共同制定新型细胞产品的评价标准
价值导向定价:开发基于疗效的支付模式,将前期高成本分摊到长期健康收益中
当一位白血病患者接受经过基因编辑的造血干细胞移植而获得治愈时,我们见证的不仅是一名患者的康复,更是整个医学范式的转变。细胞不再仅仅是治疗的目标,更成为治疗的工具;基因不再仅仅是疾病的根源,更成为修复的蓝图。
"我们正站在医学史上一个独特时刻,"某诺贝尔奖得主在近期演讲中表示,"过去,医学的发展是理解疾病;今天,医学的前沿是重编程生命。这不是科幻,而是正在发生的现实。"
随着基因编辑技术的精准度不断提高,细胞疗法的成本持续下降,以及产业化挑战被逐一攻克,我们有理由相信:精准细胞编程将从实验室的奇迹转变为临床的常规,为全球数百万患者带来希望。那些能够融合尖端科学、工程创新和商业智慧的企业,将在这一变革中扮演关键角色,共同书写人类健康的新篇章。
声明:本网所有转载文章内容为了宣传行业动态所用,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。

