
引言:mRNA疗法的挑战与机遇
mRNA技术已在疫苗与药物开发中掀起革命。然而,其在体内的不稳定性一直是限制其临床应用的主要瓶颈。尽管环状RNA、自扩增RNA等新型RNA形式在稳定性上有所突破,但它们往往面临翻译效率低、修饰兼容性差、生产工艺复杂等问题。
为此,韩国首尔大学V. Narry Kim团队开展了一项系统性研究,从近20万个病毒序列中筛选出能显著增强mRNA稳定性与翻译效率的RNA稳定性增强子,并揭示其通过TENT4介导的混合尾巴延伸机制实现长效表达。该研究发表于 Nature Biotechnology,题为《RNA stability enhancers for durable base-modified mRNA therapeutics》。
一、研究背景:mRNA稳定性的核心机制
mRNA在细胞质中的降解主要依赖于去腺苷酸化——CCR4–NOT复合物逐步缩短poly(A)尾巴,一旦长度低于阈值,mRNA即被降解。同时,poly(A)尾巴也通过与PABPC结合,促进翻译起始。因此,维持poly(A)尾巴的完整性是延长mRNA寿命与增强蛋白表达的关键。
病毒在进化中发展出一套机制:通过特定RNA模体招募TENT4酶,在poly(A)尾巴上添加混合核苷(非纯A),形成“混合尾巴”,从而抵抗去腺苷酸化,增强mRNA稳定性。
二、研究设计:系统性筛选病毒RNA元件
研究团队构建了一个包含196,277个病毒基因组片段的文库,涵盖337种病毒、297个属,覆盖所有Baltimore分类系统。通过两步筛选:
初筛:将病毒片段插入EGFP的3′UTR,整合至HEK293T细胞,通过荧光强度筛选出增强蛋白表达的元件。
复筛:将富集片段插入荧光素酶报告基因的3′UTR,合成m1Ψ修饰的mRNA,转染至HCT116细胞,通过RNA测序评估其稳定性。
最终,从10,784个富集片段中鉴定出131个显著增强m1Ψ修饰mRNA稳定性的元件,进一步验证后得到11个核心元件(A1–A11)。
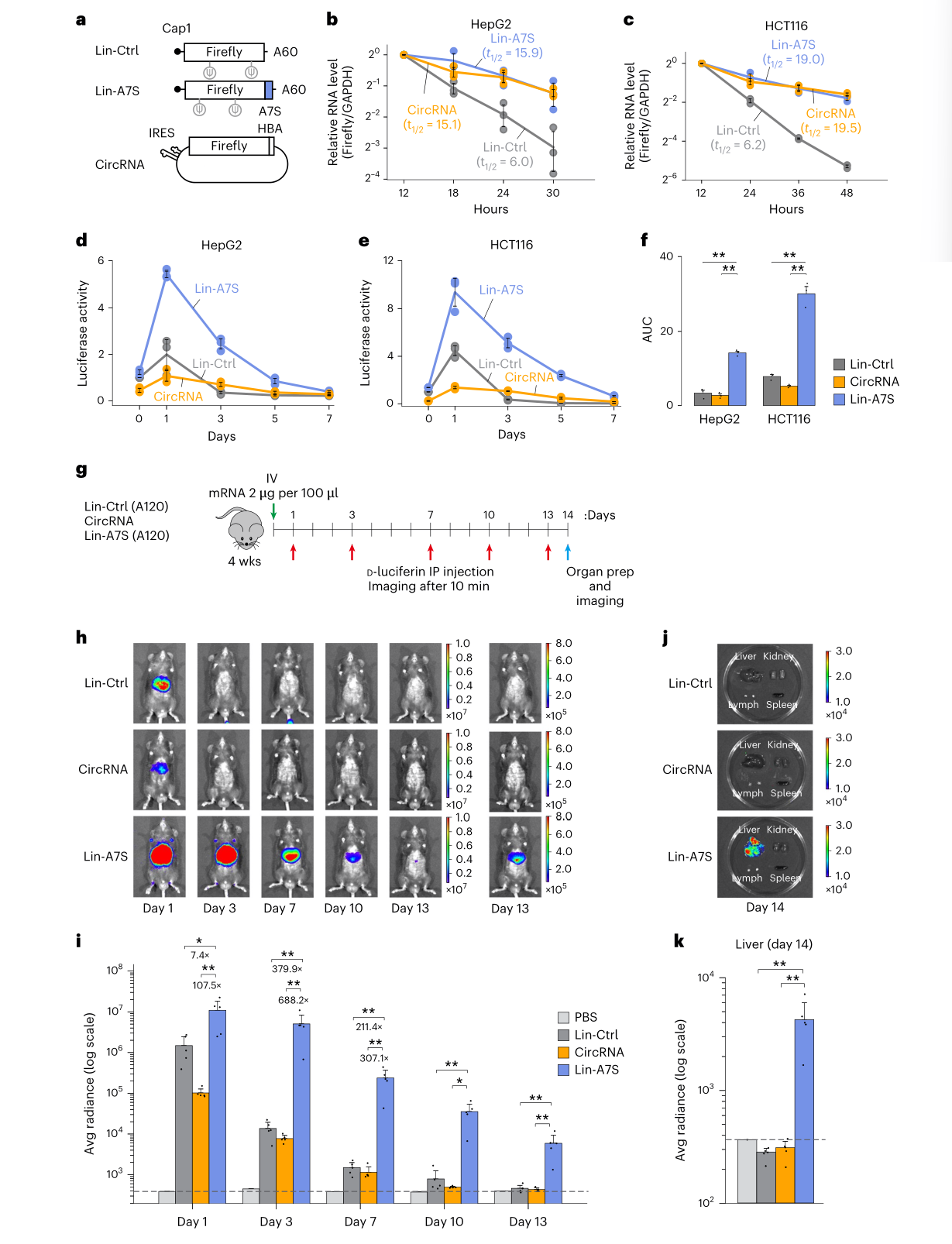
三、关键发现:A7脱颖而出
在11个验证元件中,A7(来源于Melegrivirus A) 表现最为突出:
兼容性强:在m1Ψ和m5C修饰下仍保持活性;
跨细胞类型有效:在肝细胞、肺上皮细胞、T细胞等多种细胞中均有效;
机制独特:不依赖常见的CNGG模体或ZCCHC14辅因子,而是通过未知适配蛋白招募TENT4;
结构明确:通过深度突变扫描,确定其关键结构域为内部环(IL)和茎环SL2。
四、机制解析:TENT4依赖的混合尾巴延伸
研究发现,几乎所有有效元件(除A7外)均含有CNGG模体,通过ZCCHC14招募TENT4,催化poly(A)尾巴延伸,形成混合尾巴,抵抗去腺苷酸化。
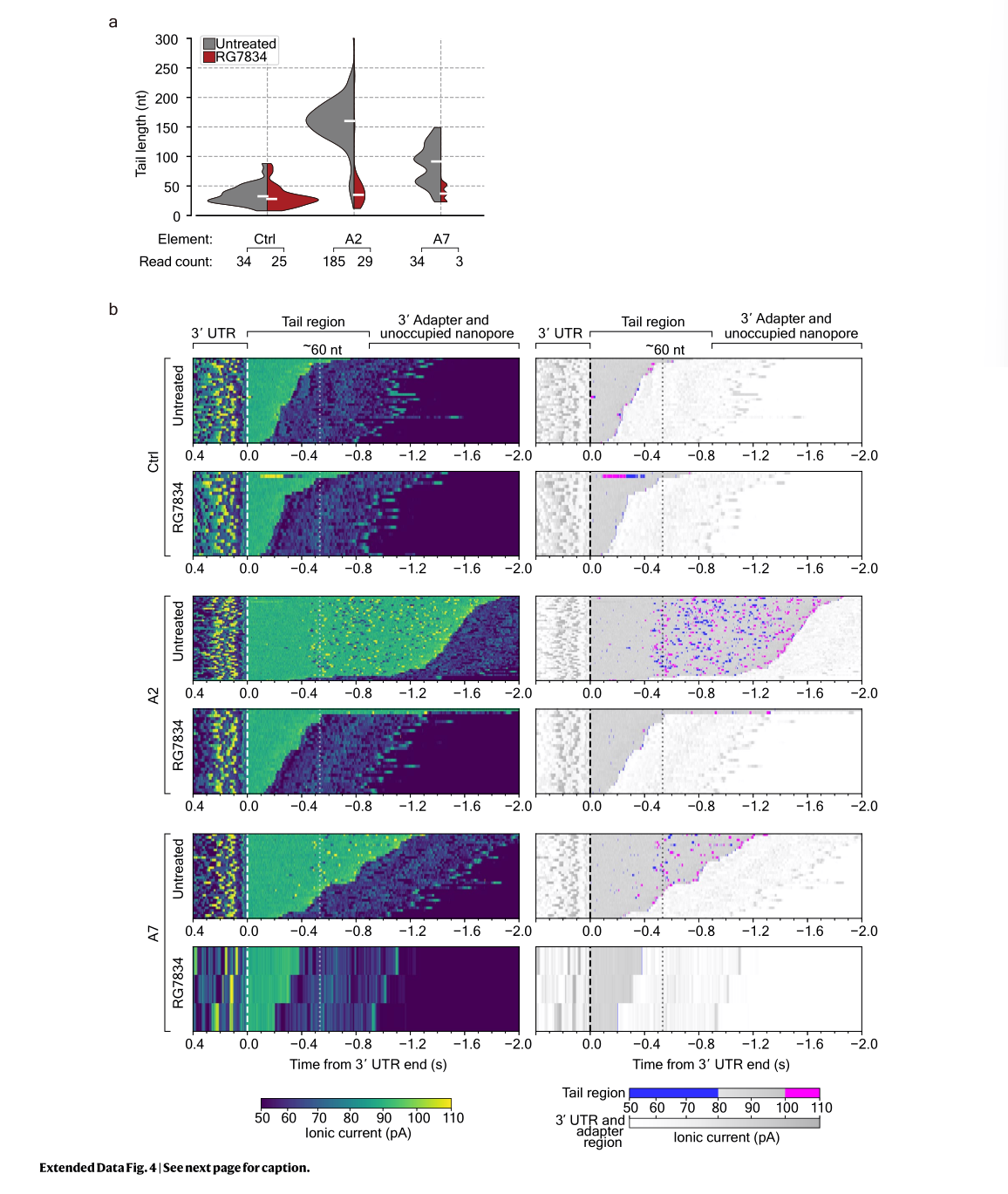
而A7虽无CNGG模体,同样依赖TENT4,提示其可能通过新型适配蛋白发挥作用。纳米孔直接RNA测序进一步证实,A7与A2等元件能显著延长poly(A)尾巴,并在TENT4抑制剂处理后失效。
五、性能对比:A7线性mRNA媲美环状RNA
研究团队将A7插入线性mRNA中,并与优化后的环状RNA进行对比:
半衰期:在HepG2和HCT116细胞中,A7线性mRNA的半衰期与环状RNA相当(约15–19小时);
蛋白表达:A7线性mRNA在所有时间点均显著高于环状RNA,总体蛋白输出提升5–6倍;
体内表现:在小鼠肝脏中,A7 mRNA在第13天仍可检测到荧光信号,表达持久性显著优于环状RNA。
六、应用前景:从基础研究到临床转化
A7及其他病毒RNA稳定性增强子具有广泛的应用潜力:
治疗领域:适用于蛋白替代疗法、肿瘤免疫治疗、基因编辑、组织重编程等;
细胞特异性:A2在单核细胞中表现优异,A7在肝细胞和T细胞中效果显著;
工艺优势:线性mRNA生产工艺简单、成本低,适合大规模制备;
安全性:避免自扩增RNA可能引发的免疫反应风险。
七、总结与展望
本研究通过大规模病毒基因组筛选,发现了一系列能显著增强碱基修饰mRNA稳定性与翻译效率的RNA元件,其中A7表现最为全面与稳健。它不仅使线性mRNA具备环状RNA般的稳定性,还保留了高效的帽依赖性翻译能力,为mRNA疗法的长效化提供了新工具。
未来,A7及其衍生物有望成为下一代mRNA治疗平台的核心组件,推动基因治疗、疫苗开发与精准医疗的进一步发展。