行业动态

合成 mRNA 疗法正迅速成为基因治疗、疫苗与细胞治疗领域的重要技术路径,但其主要挑战之一在于如何精确调控 mRNA 在体内的翻译,以避免脱靶或副作用。2025 年 10 月 6 日,《Molecular Therapy – Nucleic Acids》上发表了一篇新研究,提出了一种基于反义寡核苷酸(ASO, antisense oligonucleotide)的“翻译开关”策略:即通过设计 ASO 在 mRNA 上形成可抑制翻译的结构,直至遇到特定的触发 RNA(trigRNA)时,解除抑制、恢复翻译。作者在体外体系(兔网织红细胞裂解液,RRL)和细胞(HEK293T 细胞)中进行了评估,并探索了多种 ASO 传递方式(如脂质或树枝聚合物修饰)。论文证明:通过调节 ASO 的杂交长度、位置及化学修饰,可实现较高的 “OFF/ON” 动态范围(在 RRL 中达到 ~86 倍)。尽管在细胞内的效率仍受 ASO 递送和稀释问题约束,但该研究为无需表达额外调控蛋白的 mRNA 调控策略提供了新方向。
背景与意义 — 为什么要做这种“开关”设计?
mRNA 疗法的“可控性”需求
合成 mRNA 技术(如 mRNA 疫苗、mRNA 编码疗法)近年来发展迅猛。但与此同时,控制其“剂量—作用时间—组织特异性”成为关键瓶颈。尤其是在某些情境下,mRNA 在非目标组织被翻译可能产生不良效果,或在治疗窗口之外存在持续表达风险。因此,设计一种能按需“关闭 / 打开” mRNA 翻译的手段,是未来安全性和精度控制的重要路径。
当前调控方法的局限
现有为 mRNA 加装“可开关元件”(如小分子依赖开关、核酸适配子传感器、mRNA 自身结构折叠调控等)大多依赖于额外表达调控蛋白、感应元件复杂或可编程性差。若能借助一种仅由寡核苷酸就能“播控” mRNA 翻译开关,理论上更简洁、更模块化、更具可定制性。
ASO 在 RNA 靶向调控中的优势
反义寡核苷酸 (ASO) 是一类短链核酸类似物,能够通过序列互补与目标 RNA 杂交,形成双链结构,从而调控 RNA 的剪接、降解或翻译。ASO 在基因治疗和 RNA 靶向干预领域已有多个前例或在研项目(例如用于稀有病、神经系统疾病等方向)PMC+1。本研究即在这一基础上,尝试将 ASO 的“阻遏”能力,与可逆触发(trigRNA)机制结合,构建条件可控的翻译开关。
技术路线与设计思路
该研究的核心思路可以概括为三步:
设计抑制型 ASO — 将其与合成 mRNA 匹配
在目标 mRNA 上设计一段与之互补的 ASO,使其能够与 mRNA 杂交,从而阻断 mRNA 被核糖体识别或延伸翻译,达到“OFF”状态。
设计触发 RNA(trigRNA)解除抑制
同时设计一个与 ASO 更强互补或竞争性的 trigRNA。当 trigRNA 存在时,它会与 ASO 结合(或置换 ASO–mRNA 结构),从而解除 ASO 对 mRNA 的抑制,使 mRNA 恢复被翻译(“ON” 状态)。
优化 ASO 参量、化学修饰与传递策略
为了使这一开关系统在实际生物体系中可用,作者系统探索了多个变量:
ASO 杂交长度(长链 vs 短链)
ASO 杂交位置(靠近 5′ 端、内部或 3′ 端)
ASO 化学修饰(例如常用的磷酸骨架、核糖修饰、PMO 等)
传递方式:直接转染、胆固醇或树枝聚合物 (dendrimer) 修饰 ASO,改善细胞摄取效率
通过这些参数组合筛选,作者力图找到兼顾“低背景抑制”(OFF)与“高触发效率”(ON)的设计。
实验结果要点与性能评价
在 RRL(兔网织红细胞裂解液)体系下的模型验证
在体外裂解液体系中,作者用不同长度、不同浓度的 ASO/trigRNA 组合进行了翻译抑制与重启测试。
结果表明:随着 ASO 杂交长度或浓度增加,其对 mRNA 的翻译抑制效果越强;与此同时,在 trigRNA 存在时的“恢复翻译”效率越高,从而提升 OFF/ON 的动态比值。
作者报道,在最优条件下,这种系统在 RRL 中可实现高达 86.4 倍(~ 86×) 的动态范围(即 ON 状态的表达水平与 OFF 状态之比约 86 倍)。
这说明:在无细胞体系中,这个设计具备相当理想的可控开关性能。
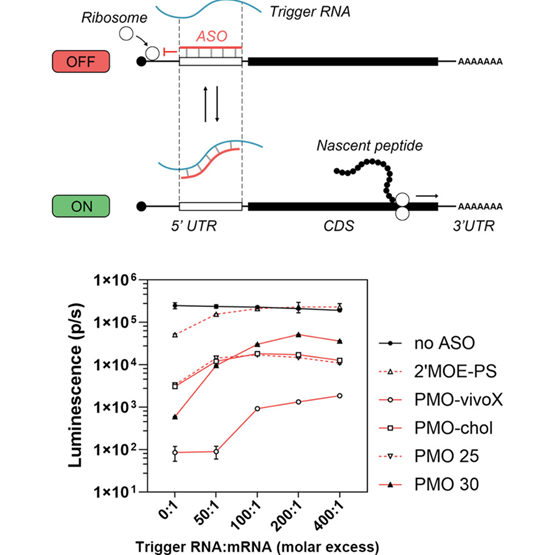
在 HEK293T 细胞(体内近似)中的测试
将 ASO 与 mRNA 共同转染进入 HEK293T 细胞,考察其在细胞内的抑制/触发性能。
为提升 ASO 在细胞内的摄取效率,作者尝试将 ASO 修饰为带胆固醇(cholesterol) 或 树枝聚合物(dendrimer)连接 的形态,以增强其膜透性或被细胞吸收。
在细胞水平,作者观察到:这些修饰确实提升了 ASO 的摄取,从而加强了翻译抑制效果;在 trigRNA 存在时,也能诱导一定程度的恢复(即 ON 状态)。
不过,细胞水平所能实现的 OFF/ON 动态范围较低,仅约 1.79 倍。也就是说,在细胞内,背景抑制和触发恢复之间的差距远远小于在体外体系的理想状态。
综合性能 / 局限指标总结
维度 | RRL 体系 | 细胞体系(HEK293T) | 主要瓶颈 / 限制因素 |
OFF 抑制效率 | 高 | 适中 | 细胞内 ASO 的稳定性与浓度不够高 |
ON 触发恢复效率 | 较高 | 较弱 | trigRNA–ASO 竞争机制在细胞内达不到理想平衡 |
OFF/ON 动态范围 | ~ 86 倍 | ~ 1.79 倍 | 主要受 ASO 递送效率、细胞稀释、降解影响 |
传递方式效果 | N/A(体外) | 胆固醇修饰、树枝聚合物提高 ASO摄取 | 但仍难以完全克服胞内稀释与降解问题 |
论文中也强调,尽管在体外体系表现令人鼓舞,但在真实细胞、体内环境中,ASO 的细胞摄取、胞内稳定性、分布和稀释问题仍是制约这类“开关”系统落地的关键挑战。
创新点、优势与挑战
主要创新 / 优势
无需额外蛋白表达
这一开关策略完全基于核酸–核酸相互作用,不依赖于外源表达的调控蛋白(如转录因子、翻译调控因子等),简洁、模块化。
可编程性强 & 可扩展性好
通过改变 ASO / trigRNA 的序列组合、干扰位置、长度、化学修饰等手段,可针对不同目标 mRNA 进行定制。原则上具有“通用开关模块”的潜力。
体外性能已达到较高动态范围指标
在无细胞体系中,能够实现 ~86 倍的 OFF/ON 控制比,说明这种设计在理想环境下具备较大潜力。
兼顾实际可传递性设计
作者不仅停留在分子设计层面,还实际尝试将 ASO 用胆固醇或树枝聚合物修饰以增强细胞摄取,这一点体现其向应用落地探索的姿态。
主要挑战与待突破问题
ASO 传递 & 细胞摄取效率不足
虽然在细胞水平进行了胆固醇 / 树枝聚合物修饰尝试,但仍难以将 ASO 递送至足够浓度的胞质空间,以保证持续且强效的抑制。
胞内降解、稀释与拮抗干扰
在细胞、组织环境中,ASO 可能被核酸酶降解、被细胞分隔隔室隔离、被其他 RNA 结合蛋白竞争干扰等,导致实际抑制强度下降或触发不彻底。
trigRNA 效率与竞争优势不足
在细胞内,trigRNA 需要有效竞争或置换 ASO–mRNA 结合,这要求其浓度、亲和性、稳定性必须足够高,现实中较难做到同时满足这些条件。
靶向组织 / 体内环境适应性尚未验证
本研究尚未在动物模型中证实该系统在组织/体内能可靠、反复地切换翻译状态。体内复杂性(如免疫反应、核酸清除、组织屏障、局部浓度梯度等)可能大幅折损性能。
安全与特异性风险
ASO 本身可能存在脱靶结合风险、免疫刺激或毒性。
高浓度 ASO / trigRNA 的长期存在可能与内源 RNA 相互作用产生干扰。
在体内应用中,还要关注核酸给药载体、修饰物的安全性、生物相容性、代谢清除等问题。
论文中作者也明确指出:未来若要推动该策略临床应用,必须进一步提升 ASO 的稳定性、减少细胞内失活 / 稀释、改善递送效率,以及在体内系统中验证其可重复性与安全性。
行业前景与发展方向(讨论与展望)
有希望发挥作用的应用场景
可控表达型 mRNA 疗法
在一些高风险 / 高剂量 /组织特异需求的场景,希望 mRNA 只在特定触发时段表达(如肿瘤微环境、疾病相关信号触发、组织特异启动子等)。这种 ASO 开关策略,可以在“基础沉默 → 病理信号触发恢复”的机制中发挥作用。
安全阈控 / 紧急“断表达”功能
在 mRNA 疗法中,一旦出现潜在副作用或“用药外泄”风险,有一种方式可以“临时关闭”其表达,是一种安全阈控机制。若 ASO 系统可以被设计为可逆开关,则具备安全开关的意义。
多输入逻辑控制
将 ASO–trigRNA 机制与其他 RNA 传感器(如 miRNA、siRNA、核酸适配子等)组合,可以构建更复杂的“逻辑门”控制系统(如“只有在 A 且 B 存在时才开启表达”)。这种模块化控制是未来合成生物 / 智能 RNA 设计的方向。
未来研发建议
高效传递载体的研发
要让该开关系统在细胞乃至体内有效,还必须在 ASO / trigRNA 的载体、修饰、给药方式等方面下功夫。纳米载体(脂质纳米粒、聚合物纳米粒、病毒衍生载体、外泌体等)可能是关键。
优化 ASO / trigRNA 化学修饰
更稳定、抗降解、低免疫刺激的寡核苷酸修饰(如硫代/氟修饰、LNA、PMO、PNA 等),以及对热力学亲和力、解离动力学的优化设计,都是提升系统性能的重要技术路径。
体内模型与长期效应验证
接下来应开展动物模型实验:验证该开关在活体组织中的抑制/触发性能;评估其耐用性、细胞毒性、脱靶风险、免疫反应等。长期观察稳定性与可重复切换能力。
与现有 RNA 控制技术相结合
将该 ASO 开关与现有的小分子依赖开关、核酸适配子、内源调控元件(如 miRNA 反应器)等融合,构建更鲁棒、更灵活的控制系统。
行业标准与监管路径
若未来进入临床阶段,还需考虑其作为“可调控 mRNA 载体”的监管路径、质量标准、毒理学评估标准等。此外,其与核酸药物、基因疗法等领域交叉,可能需要新的法规考量。
风险与挑战(商业 / 技术角度)
成本与工艺复杂性:对每一个目标 mRNA 设计对应的 ASO / trigRNA 对,可能增加制造复杂性与成本。
尺度放大问题:在大规模生产、纯化、稳定性保障、批间一致性等方面可能面临挑战。
竞争技术路径:目前许多公司 / 研究团队也在开发RNA 传感器、小分子调控开关、条件剪接控制元件等,可替代或竞争该方案。
安全性与免疫反应:核酸给药系统、载体材料、修饰物可能引起免疫反应或毒性,需要严谨的安全性评估。
结语(行业观点)
这篇发表于 2025 年 10 月的论文,代表了一种在 mRNA / 合成生物领域颇具前瞻性的思路——通过 ASO 构建可逆、条件触发的翻译开关,从而在不依赖额外蛋白的前提下,对合成 mRNA 的表达进行精细调控。论文在体外体系中取得了令人鼓舞的性能指标(OFF/ON 达 ~86 倍),但在细胞内(HEK293T 体系)表现仍有较大落差(约 1.79 倍)。关键瓶颈在于 ASO 的胞内递送、稳定性、稀释/降解、trigRNA 竞争机制效率等。
从行业视角来看,该方法具备成为“模块化 mRNA 表达控制器” 的潜力,若能在载体技术、核酸化学优化、体内验证上取得突破,有望成为 mRNA 疗法安全性与精准性提升的一项重要工具。但当前还处于概念 / 初步实验阶段,距离临床落地与产业化仍需较长发展周期。
声明:本网所有转载文章内容为了宣传行业动态所用,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。

