近年来,mRNA疗法因其安全性高、研发生产快、成本低等优势成为疾病治疗的新方向,但其应用受限于外源性mRNA翻译效率(TE)较低的问题。mRNA的翻译效率受编码区(CDS)和非翻译区(UTR)共同影响,尤其是5′ UTR直接参与核糖体结合,是调控TE的关键。目前CDS优化研究较多,而5′ UTR因机制复杂,优化手段有限。现有方法多依赖已知高效序列或遗传算法,往往只能产生少量通用序列,忽略基因特异性,效果受限。
深度学习方法在生物序列预测方面展现出强大能力,结合大规模并行报告基因检测(MPRA)提供的高通量5′ UTR-TE数据,为TE优化提供了新思路。已有研究基于该数据构建了TE预测模型,但未能实现基因特异性序列设计。为此,我们提出UTailoR框架,基于生成对抗网络思想,首先训练判别模型预测TE,进而指导生成模型优化5′ UTR序列。该方法能够针对特定基因生成保留原有特征且TE更高的定制化序列,显著提升优化效果与适用性。
在 mRNA 疫苗和核酸药物快速发展的背景下,如何进一步提升外源性 mRNA 的翻译效率,一直是限制其临床应用与产业化的核心瓶颈。近期,研究团队在 iScience 期刊发表题为 “Enhancing mRNA translation efficiency with discriminative and generative artificial intelligence by optimizing 5′ UTR sequences” 的研究,提出了一种基于人工智能的计算框架 UTailoR (UTR tailor),为解决 mRNA 翻译效率低的问题提供了创新思路。
mRNA 药物的挑战:翻译效率不足
mRNA 技术以其开发周期短、可编程性强而广泛应用于传染病疫苗、癌症免疫治疗及罕见病疗法。然而,在实际应用中,mRNA 翻译效率不足导致药效不稳定,剂量需求增加,也增加了生产和临床应用的成本。因此,提升 mRNA 的翻译效率成为行业关注的重点。
在 mRNA 分子结构中,5′ 非翻译区(5′ UTR) 对核糖体识别和翻译启动至关重要。通过优化 5′ UTR 序列,可以有效增强蛋白质的表达水平。但如何高效、精准地优化序列,一直缺乏系统化工具。
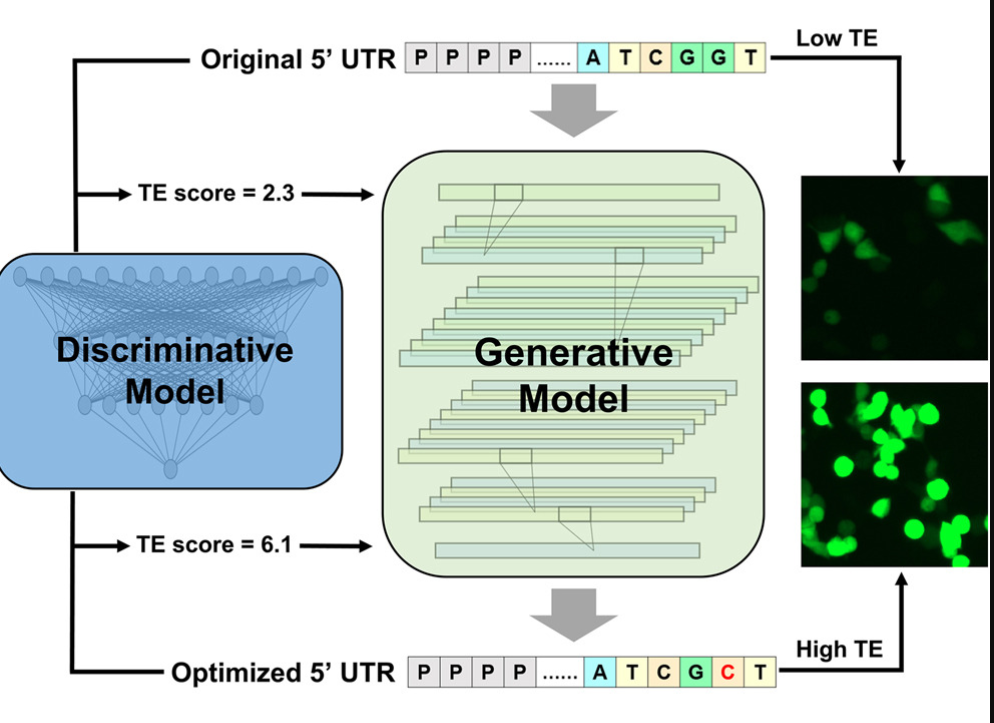
UTailoR 框架:AI 驱动的双步骤策略
研究团队开发的 UTailoR 框架,整合了两类人工智能模型:
判别模型(Discriminative Model)
基于深度学习,能够预测不同 5′ UTR 序列的翻译效率。
为后续优化提供可靠的评估基础。
生成模型(Generative Model)
这种“先预测、再生成”的双步骤设计,保证了序列优化的科学性与实用性。
实验验证:翻译效率提升约 200%
在多组实验中,研究人员将 UTailoR 优化的 5′ UTR 序列与对应的原始序列进行对比,结果显示:
优化后序列的翻译效率提高约 200%;
序列结构保持高度相似,降低了突变风险;
方法操作简便,可直接在线获取使用。
这一成果显示,UTailoR 不仅具有理论创新性,更具备产业落地的可行性。
行业意义与应用前景
药物研发加速器
为 mRNA 疫苗、治疗性蛋白、罕见病疗法提供高效的序列优化工具。
有望降低剂量需求,减少副作用,提高生产经济性。
AI + 核酸药物的典型案例
展示了人工智能在分子生物学和药物设计中的巨大潜力。
为未来核酸药物设计开辟出“AI 赋能”的新方向。
易获取与广泛应用
UTailoR 框架可在线使用,降低了科研人员的技术门槛。
有望成为学术研究与产业界的通用工具。
声明:本网所有转载文章内容为了宣传行业动态所用,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。