行业动态
(ALS)是一种神经退行性疾病,其主要特征是运动神经元变性,但超过半数患者会伴随由额颞叶变性(FTLD)引起的认知行为障碍,表明疾病广泛影响大脑皮层功能。
在遗传层面,C9orf72基因的六核苷酸重复扩增是ALS与FTLD最常见的共同遗传因素,可导致毒性蛋白积累、RNA结合蛋白功能异常及细胞通路紊乱。这种分子层面的共性突出表现为关键RNA结合蛋白(RBP)的失调,其中TDP-43的核内耗竭和胞质聚集是标志性病理改变。
此类RBP的功能异常会破坏转录后调控过程。选择性多聚腺苷酸化(APA)作为一种关键机制,可通过改变mRNA的3‘端影响其稳定性、定位和翻译。研究表明,ALS中存在脑区特异性的APA模式异常,但其在特定细胞类型中的调控机制尚不清楚。近年来,单细胞RNA测序技术的发展,特别是新兴的APA定量方法,为在细胞分辨率下揭示ALS-FTLD谱系的转录后调控缺陷提供了前所未有的机遇。
近期,发布在Cell杂志上的一项研究 “Single-nucleus transcriptome atlas of orbitofrontal cortex in ALS with a deep learning–based decoding of alternative polyadenylation mechanisms”,通过对肌萎缩性侧索硬化症(ALS)患者的大脑前额叶皮层进行单核 RNA 测序,并结合深度学习模型对可变 3′ 端多腺苷化(APA, alternative polyadenylation)机制进行解析,为我们理解 ALS / FTLD 的分子病理、细胞特异性变化和调控网络提供了新的视角。

一、研究背景与意义
1. ALS / FTLD 的复杂性与细胞异质性
肌萎缩性侧索硬化症(Amyotrophic Lateral Sclerosis, ALS)与额颞叶变性(Frontotemporal Lobar Degeneration, FTLD)在临床和病理学上存在重叠,且常被视为同一疾病谱系中的不同表现形式。
虽然大量研究聚焦于运动神经元、TDP-43 蛋白病理、细胞应激反应等,但在大脑皮层(特别是前额叶相关区域)中,不同类型神经元与胶质细胞如何发生分子重编程、相互作用、产生神经毒性,是尚不完全清晰的关键领域。
技术上,传统的整体组织转录组掩盖了细胞类型差异,而 单核 / 单细胞测序 能够揭示不同细胞类型的基因表达特征变化。
2. 可变 3′ 端多腺苷化(APA)在神经疾病中的潜在作用
APA 是一种常见的转录后修饰机制,通过选择不同的多腺苷化位点影响 mRNA 的 3′ 端长度,从而调控 mRNA 稳定性、翻译效率及亚细胞定位。
在神经退行性疾病中,APA 调控尚属于较少被系统分析的领域。研究者怀疑,在 ALS / FTLD 中,APA 可能是隐藏在基因表达变化之下的一层重要调控机制。
但直接将 APA 事件与细胞类型特异性表达网络关联起来,并通过模型预测其调控因素,一直是技术与计算上的难点。
基于这些背景,论文团队提出:对 ALS 患者大脑的单核转录组分析,结合深度学习方法来解码 APA 调控机制,可能带来对 ALS / FTLD 分子病理的新理解。
二、样本选择与实验设计
1. 取样区域与患者类型
研究聚焦于 眶额皮层(orbitofrontal cortex),该区域在 ALS / FTLD 病理过程中可能受到累及。
病例涵盖两类:带有 C9orf72 基因变异(同时有和没有 FTLD 表现型)以及 散发型 ALS(sALS)。
对照组则取自无神经系统疾病的健康人群。
2. 单核 RNA 测序与数据处理
使用 单核 RNA 测序(snRNA-seq) 进行高通量测序,以克服组织解离带来的细胞损失问题。
对测序数据进行质控、核分选、细胞聚类和注释,将各个细胞核归类为神经元、星形胶质细胞、小胶质细胞、少突胶质细胞、血管相关细胞等主要类型。
对不同子类型的核进行表达差异分析(DE, differential expression),识别不同疾病亚型和对照组之间在各类细胞中的异常表达基因。
3. 跨区域 / 跨数据集验证
为了验证这些转录组区别是否具有通用性,研究者将本研究结果与 其他大脑皮层区域 的公开 ALS / FTLD 转录组数据进行比对。
通过这种交叉验证,确保发现具有泛化性,而不是局限于某一区域或样本偏倚。
4. APA 模型构建与预测 — APA-Net
为理解 APA 事件的驱动机制,作者设计了 APA-Net 模型:
输入层整合转录本序列特征(包括 3′ UTR 的序列上下文)和 RNA 结合蛋白 (RBP) 表达谱;
构建多模态深度学习架构,对特定基因在特定细胞类型中可能使用的多腺苷化位点 (polyA sites) 进行预测。
用该模型预测各个细胞类型中 APA 的差异使用情况,并与实际测序观测结果对比验证。
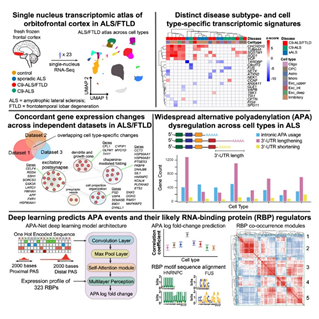
三、主要发现与结果解析
1. 细胞类型特异性转录组重编程
在不同 ALS 病例(C9orf72 及散发型)与对照组之间,神经元细胞 表现出最显著的转录组变化。
这些变化集中在以下几个核心路径:
线粒体功能 / 能量代谢
蛋白质稳态 / 蛋白质折叠与降解
染色质重塑 / 组蛋白修饰 / 核结构
在跨区域对比中,部分基因(如 STMN2、NEFL)在多个皮层区域与 ALS 亚型中均呈上调趋势,说明它们可能是 ALS 病理中保守的通路节点。
2. APA 调控异常分布
虽然基因差异表达(DEG)分析揭示了广泛的基因表达异常,但研究者发现 APA 事件与 DEG 本身相关性较弱,说明 APA 调控是另一层相对独立的调控机制。
不同细胞类型中,APA 事件表现出明显的特异性:某些基因在神经元中偏向使用近端 polyA 位点,而在胶质细胞中可能使用远端位点。
这种差异可能影响 mRNA 3′ 端长度、稳定性与翻译效率,对细胞类型功能状态产生影响。
3. APA-Net 模型预测与验证
APA-Net 模型在交叉验证中显示出良好预测性能,能够较准确地区分在特定细胞中某个基因更可能使用哪个 polyA 位点。
模型预测结果与实际测序数据高度一致,验证了该模型在多细胞类型背景下对 APA 调控的解码能力。
模型还揭示出若干与 RBP 表达相关的调控特征,对未来干预点提供线索。
四、研究贡献与创新点
该研究在多个维度上具备重要的学术价值与创新性:
大脑前额叶皮层的 ALS 单核转录组图谱
第一次在眶额皮层构建 ALS / FTLD 的单核表达图谱,揭示该脑区在疾病进展中的细胞类型特异性变化。
深入探究 APA 这一转录后调控层面
将 APA 纳入神经退行性疾病的系统研究之中,并在单核水平上辨别其细胞类型特异性模式。
多模态深度学习模型 APA-Net
通过整合序列特征 + RBP 表达谱预测 APA 使用偏好,为理解 APA 调控机制提供可解释的预测工具。
模型具有跨细胞类型通用性,未来可推广用于其他组织 / 疾病背景。
跨区域与跨亚型验证
所得结论在其他皮层区域数据集中得到复现,增强了研究结果的可靠性和广泛意义。
五、行业意义与未来展望
1. 对神经退行性疾病研究的推动
此研究为 ALS / FTLD 的分子病理提供了优质资源与新思路,未来可用于挖掘新的生物标志物或治疗靶点。
APA 调控作为一条尚未充分挖掘的调控通路,可能成为未来干预 ALS / FTLD 的新方向。
2. 人工智能 + 多组学方法的融合示范
APA-Net 模型的成功应用揭示了 AI 在生物医学中的跨模态解码能力,这将为其他领域(如癌症、免疫疾病)借鉴。
类似策略可用于将 RBP 网络、序列特征与转录组 / 代谢 / 表观遗传数据融合,解析复杂调控网络。
3. 核苷酸 / 核酸工程 / RNA 领域的关联价值
虽然本文不是直接针对核苷酸产品或 RNA 药物研发,但其在 mRNA / RBP / polyA 调控机制上的洞察,对 RNA 设计、RNA 表达稳定性优化、RNA 结构工程等具有一定参考意义。
未来在 RNA 疗法设计中,还可能考虑利用 APA 调控机制,提高 mRNA 的稳定性或表达效率。
4. 资源价值与后续可扩展性
本文构建的单核转录组图谱及 APA 调控数据,可作为公共资源供社区研究者调用。
APA-Net 模型若开源,将为其他组织 / 疾病背景的 APA 解码提供通用工具。
声明:本网所有转载文章内容为了宣传行业动态所用,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。

