行业动态

在新冠疫情后,mRNA技术已从实验室走向全球舞台,成为生物医药领域的明星。然而,这项革命性技术背后隐藏着不容忽视的挑战:现有递送系统——病毒载体和脂质纳米颗粒(LNP)——面临着制造复杂、存储苛刻、安全风险和知识产权拥挤等问题。更令人担忧的是,传统LNP依赖石油基合成脂质,难以满足日益增长的可持续发展需求。正是在这一背景下,来自普渡大学的研究团队在《美国国家科学院院刊》(PNAS)发表了一项突破性研究,他们开发的层状弹性蛋白样多肽核酸纳米颗粒(LENN)系统,不仅克服了现有技术的局限,更为mRNA递送提供了一条"绿色制造"的全新路径。
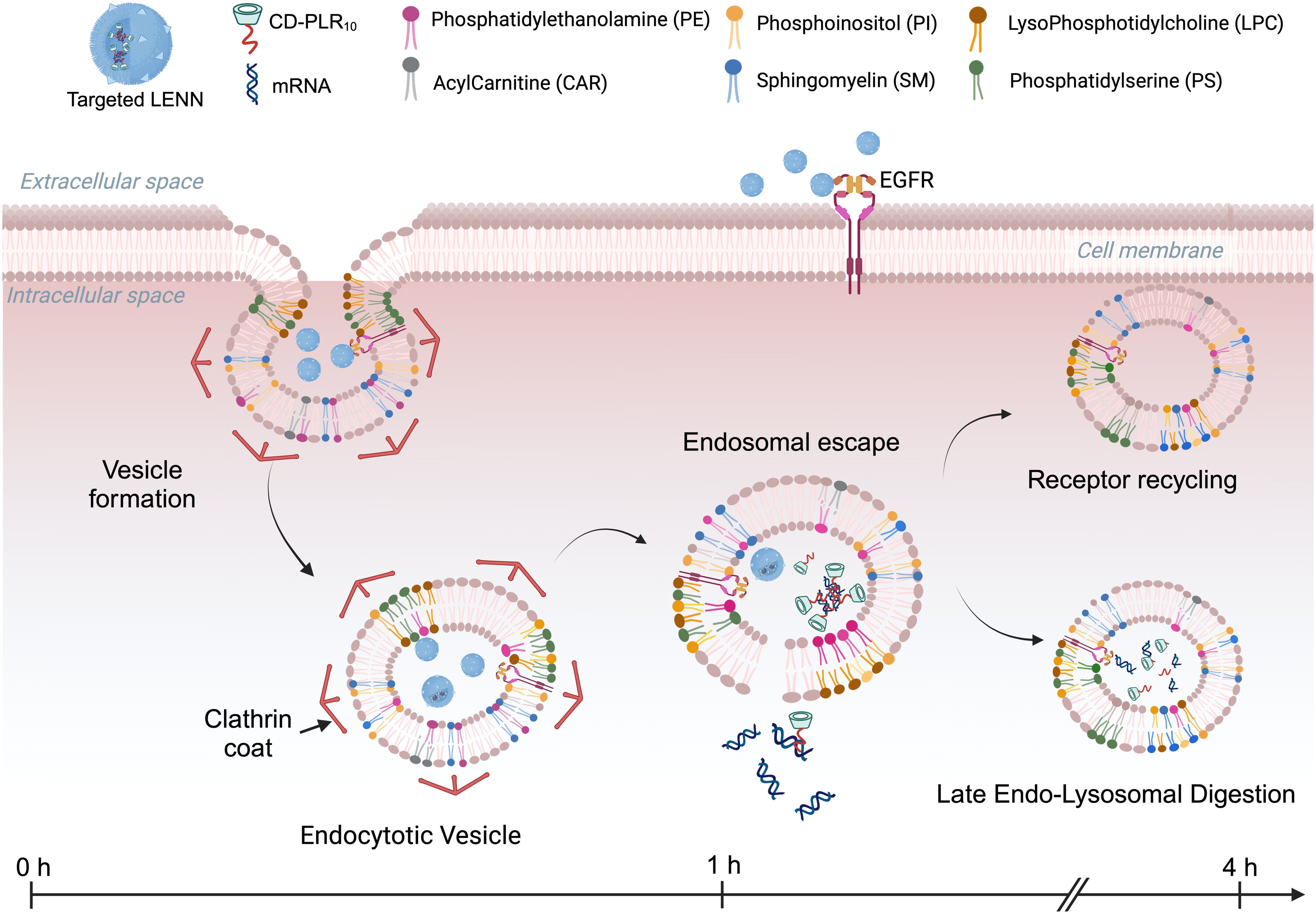
LENN系统的核心创新在于其材料来源与设计理念。传统LNP依赖石油衍生物合成的脂质,而LENN则采用基于人类弹性蛋白序列设计的生物可再生材料。这一系统由三层精心设计的组件构成:外层为弹性蛋白样多肽(ELP),中层为β-环糊精-多精氨酸结合物(CD-PLR10),内层为核心mRNA货物。其中,ELP可被设计为靶向特定受体,如表皮生长因子受体(EGFR),而CD-PLR10则通过独特的"主-客体"相互作用与ELP自组装,同时通过离子结合力压缩带负电的mRNA形成稳定核心。
"这种设计不仅解决了递送效率问题,更重要的是,它使用了可生物制造的材料,大幅降低了生产复杂性和环境足迹,"研究负责人David H. Thompson教授解释道,"我们的LENN系统可在常规实验室条件下制备,无需复杂的微流控设备,这为大规模生产铺平了道路。"
研究数据显示,LENN系统在多个关键性能指标上表现卓越。通过批量混合方法,该系统能形成30-130纳米的均匀颗粒,这一尺寸范围对于细胞摄取和体内分布极为理想。更重要的是,LENN在肝素挑战(模拟体内竞争性结合环境)下保持了近80%的包封效率,远高于传统多离子复合物。这种稳定性确保了mRNA在到达目标细胞前不会提前释放而被降解。
靶向能力是LENN的另一大亮点。研究团队在T24膀胱癌细胞模型中证明,携带EGF配体的LENN能特异性识别并结合EGFR过表达的肿瘤细胞,通过网格蛋白介导的内吞作用高效进入细胞。当加入过量游离EGF阻断受体时,细胞摄取显著减少,证实了其靶向特异性。在活体小鼠实验中,靶向LENN在肿瘤组织中的积累量是非靶向对照的2.3倍,展现了卓越的体内靶向能力。
LENN系统最具革命性的突破在于其对冻干工艺的耐受性。传统LNP-mRNA复合物必须在-70°C超低温条件下存储,严格依赖冷链运输,这不仅增加了数倍成本,更限制了其在全球资源有限地区的应用。而LENN系统在添加10%甘油作为冻干保护剂后,可在-20°C条件下以粉末形式稳定保存3天,复水后仍能保持与新鲜制备样品相当的生物活性。
"这一特性可能彻底改变mRNA药物的分发模式,"论文第一作者Saloni Darji博士指出,"想象一下,在偏远地区的诊所,医护人员只需将冻干粉末复水,就能立即使用高效mRNA药物,无需依赖复杂的冷链基础设施。这对于全球健康公平具有深远意义。"
机制洞察:脂质组学揭示内吞新视角
除了应用优势,该研究还深入探索了LENN的细胞内化机制。通过脂质组学分析,研究团队首次发现细胞磷脂生物合成的上调在纳米颗粒内化和内体逃逸中扮演关键角色。靶向LENN处理的细胞显示出显著的磷脂酰丝氨酸(PS)和磷脂酰乙醇胺(PE)水平变化,这些脂质参与膜弯曲和内吞囊泡形成,为理解纳米载体-细胞相互作用提供了新视角。
LENN技术的产业化潜力巨大。相比LNP需要复杂的微流控混合设备,LENN可通过简单的批量混合方法制备,大幅降低生产门槛。材料方面,ELP可通过微生物发酵大规模生产,摆脱了对石化原料的依赖,符合绿色化学原则。环糊精和精氨酸均为FDA批准的辅料,具有良好的安全性记录,加速了监管审批路径。
目前,该技术已由普渡大学提交专利保护,研究团队正与制药企业合作推进临床前评估。尽管从实验室到临床应用仍有距离,但LENN平台的灵活性使其不仅适用于mRNA递送,还可扩展至siRNA、质粒DNA等多种核酸药物,为癌症、遗传性疾病和感染性疾病提供新的治疗选择。
"我们并不试图完全取代LNP,而是提供一个互补的解决方案,"Thompson教授强调,"在某些应用场景,如需要靶向递送、长期存储或环境友好的情况下,LENN可能成为更优选择。多样化的递送平台将共同推动基因治疗的发展。"
LENN技术的出现对整个mRNA药物生态系统具有深远影响。首先,它为解决"最后一公里"递送问题提供了新思路,特别是对于实体瘤靶向治疗。其次,其冻干稳定性可能颠覆现有的供应链模式,降低药物成本,提高可及性。更重要的是,LENN的生物可再生特性契合了制药行业向可持续发展的转型趋势,符合ESG(环境、社会和治理)投资原则。
行业分析师预测,随着技术成熟,LENN平台可能首先在局部给药应用场景(如膀胱癌的腔内治疗)实现突破,然后逐步扩展至全身性给药。与现有LNP技术相比,LENN在专利空间上更为开阔,为企业提供了规避拥挤IP格局的机会。
研究团队已规划了LENN技术的下一步优化方向。首先,通过微流控技术进一步控制颗粒大小和均一性;其次,探索不同的靶向配体,扩展至更多疾病靶点;最后,深入研究冻干工艺,延长室温存储期限。同时,团队正与临床医生合作,设计针对膀胱癌的mRNA治疗方案,预计将在未来两年内启动首个人体试验。
"基因治疗的未来不在于单一'完美'载体,而在于拥有多种可适应不同需求的工具,"Darji博士总结道,"LENN系统代表了一种新思路:利用自然界设计的蛋白质,结合精确的工程原理,创造出既高效又可持续的递送平台。这不仅是一次技术突破,更是对生物材料设计哲学的重新思考。"
正如一位业内专家所言:"在mRNA疗法的后疫情时代,我们不再只关注'能否工作',而是'如何更好地工作'。LENN技术提供的不仅是解决方案,更是一种新的可能性。"随着研究深入和产业合作推进,这一源自人类弹性蛋白灵感的递送系统,或将为基因治疗开启一个更加绿色、精准和可及的新时代。
声明:本网所有转载文章内容为了宣传行业动态所用,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。

