疗效翻倍,副作用更低—MeDZ脂质为mRNA肿瘤免疫治疗注入新动能
来源:
|
作者:li
|
发布时间: 55天前
|
155 次浏览
|
分享到:

在mRNA疗法的革命性浪潮中,脂质纳米颗粒(LNP)作为关键的递送载体,其性能直接决定了治疗的成败。然而,传统可电离脂质在实现高效递送的同时,往往伴随着显著的炎症反应(即“反应原性”),这不仅影响患者耐受性,更可能削弱免疫治疗效果。近日,一项由赵宇等科学家发表于《自然·生物医学工程》(Nature Biomedical Engineering)的突破性研究,通过理性设计一种名为“膜破坏性两性离子”(Membrane-Destabilizing Zwitterionic, MeDZ)的新型脂质,成功在增强mRNA翻译效率与最小化LNP反应原性之间取得了前所未有的平衡,为下一代mRNA癌症疫苗的开发开辟了新路径。
一、核心挑战:mRNA递送的“双刃剑”
mRNA癌症疫苗的工作原理是将编码肿瘤相关抗原(TAA)的mRNA递送至抗原呈递细胞(APC),利用细胞自身的蛋白质合成机器生产抗原,从而激活强大的、靶向性的T细胞免疫应答。LNP是目前最主流的递送平台,其核心成分——可电离脂质,在生理pH下呈中性以降低毒性,而在酸性内体环境中则带正电,以促进与带负电的内体膜融合,释放mRNA。
然而,这一过程存在固有矛盾:
高效递送需要强膜破坏能力:为了有效逃逸内体,脂质必须具备强大的膜扰动能力。
低反应原性需要温和的相互作用:过强的膜破坏作用会触发先天免疫系统的警报,引发不必要的炎症级联反应,导致发热、疲劳等副作用,并可能抑制后续的适应性免疫应答。
因此,开发一种能智能响应环境、精准调控其活性的新型脂质,成为领域内的核心挑战。
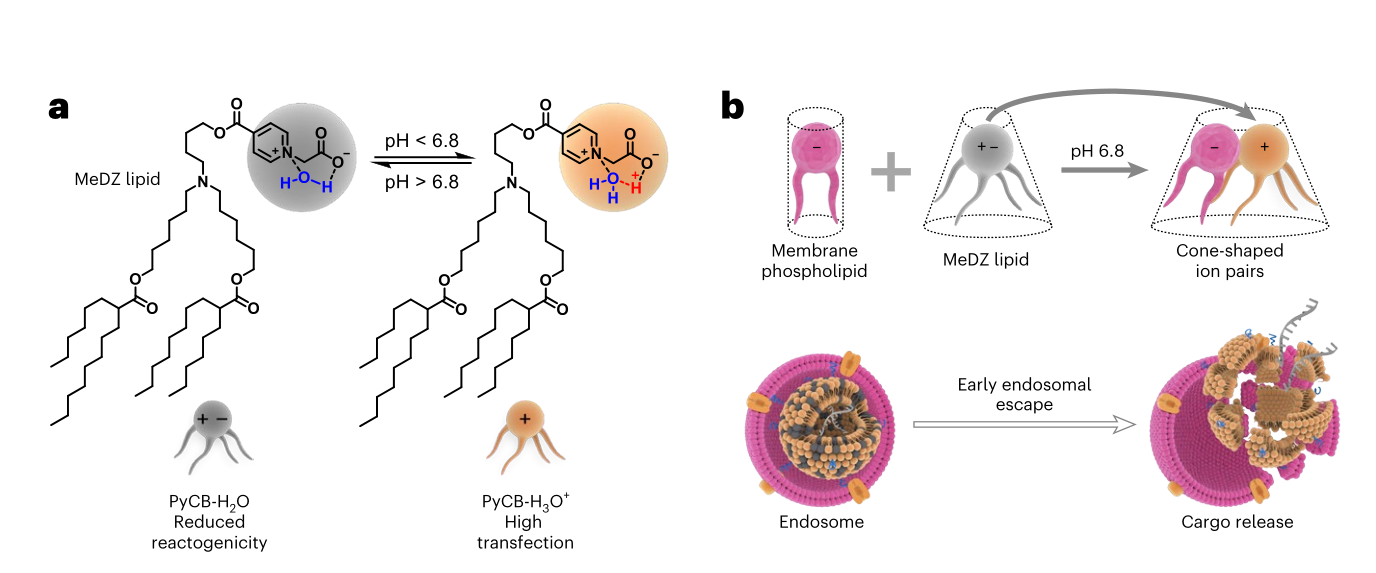
二、创新解决方案:MeDZ脂质的精妙设计
研究团队提出的MeDZ脂质,其分子结构经过精心雕琢,包含三个关键部分:
MeDZ脂质的“智能”行为体现在其对pH的双重响应上:
在生理pH(~7.4):PyCB头基与水分子形成稳定的氢键网络(PyCB-H₂O),呈现两性离子状态(同时带有正负电荷,净电荷为零)。这种高度亲水且电中性的表面特性,使得LNP在血液循环中极为“低调”,能有效规避免疫系统的识别,从而显著降低全身性反应原性。
在早期内体的弱酸性pH(~6.8):环境中的H⁺浓度升高,触发PyCB头基发生快速的双位点质子化。计算模拟揭示,这一过程使其从两性离子状态迅速转变为带正电的水合氢离子状态(PyCB-H₃O⁺)。这种电荷的急剧反转,极大地增强了LNP与带负电的内体膜之间的静电吸引力,进而驱动高效的膜融合与破坏,确保mRNA被高效释放到细胞质中。
这种“生理条件下隐形,内体环境中爆发”的精准开关机制,是MeDZ脂质实现高效低毒的核心。
三、卓越的体内表现:效力与安全性的双重胜利
研究人员将编码模型抗原(OVA)或真实肿瘤抗原的mRNA封装于含MeDZ的LNP中,并在多种小鼠肿瘤模型(包括预防性和治疗性模型)中进行了系统评估。
1. 显著增强的抗肿瘤效力:
2. 极大降低的反应原性:
关键的发现是,尽管MeDZ-LNP展现了更强的免疫激活能力,但其引发的全身性炎症反应却远低于传统LNP。
血清学分析显示,接种MeDZ-mRNA疫苗的小鼠,其促炎细胞因子(如IL-6, TNF-α)的水平显著低于接种MC3-LNP的小鼠。
这种低反应原性直接转化为更高的治疗窗口和更好的动物耐受性,为临床应用奠定了坚实的安全基础。
3. 高效的抗原表达:
四、未来展望:开启mRNA疗法新篇章
这项研究不仅报道了一种性能卓越的新型脂质MeDZ,更重要的是,它验证了“两性离子设计”作为一种通用策略的巨大潜力。通过精确调控脂质头基的化学结构,可以赋予LNP前所未有的环境响应智能,从而解耦递送效率与毒性的固有矛盾。
对于致力于核酸药物上游原料开发的企业而言,MeDZ的成功凸显了高纯度、定制化脂质在下一代LNP配方中的核心价值。随着mRNA技术从传染病疫苗向癌症治疗、蛋白替代疗法等更广阔领域拓展,对兼具高递送效率与低反应原性的先进递送系统的需求将日益迫切。MeDZ脂质及其设计理念,无疑为满足这一需求提供了强有力的工具,有望加速mRNA癌症疫苗从实验室走向临床,最终惠及全球癌症患者。
声明:本网所有转载文章内容为了宣传行业动态所用,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。