
RNA靶向治疗的机遇与挑战
在后基因组时代,科学家们发现人类基因组中超过70%的区域都会被转录成RNA,但其中仅有约1.5%用于编码蛋白质。这庞大的“非编码RNA宇宙”以及各种致病病毒的RNA,为疾病治疗提供了前所未有的靶点宝库。因此,开发能够精准、高效、安全地降解特定RNA的技术,成为生物医药领域的圣杯。
目前,RNA干扰(RNAi)和反义寡核苷酸(ASO)是主流的RNA靶向技术。然而,它们或多或少存在局限性:RNAi可能因短序列匹配而产生脱靶效应;ASO的递送效率和稳定性仍是挑战。而被誉为“RNA剪刀”的CRISPR-Cas13系统,虽具有高特异性,却因其“无差别攻击”的“旁观者切割”效应而存在细胞毒性风险。
面对这些挑战,南开大学刘树林教授团队在《Nature Communications》上发表了一项突破性研究,他们创造性地绕开了Cas13的切割活性,转而利用其精准的“GPS”定位功能,并将其与细胞内天然的“垃圾处理厂”——分子伴侣介导的自噬(Chaperone-Mediated Autophagy, CMA)通路相连接,开发出了一款名为 dCasCMA 的全新可编程RNA降解平台。
一、化“废”为宝:dCas13d与CMA的精妙联姻
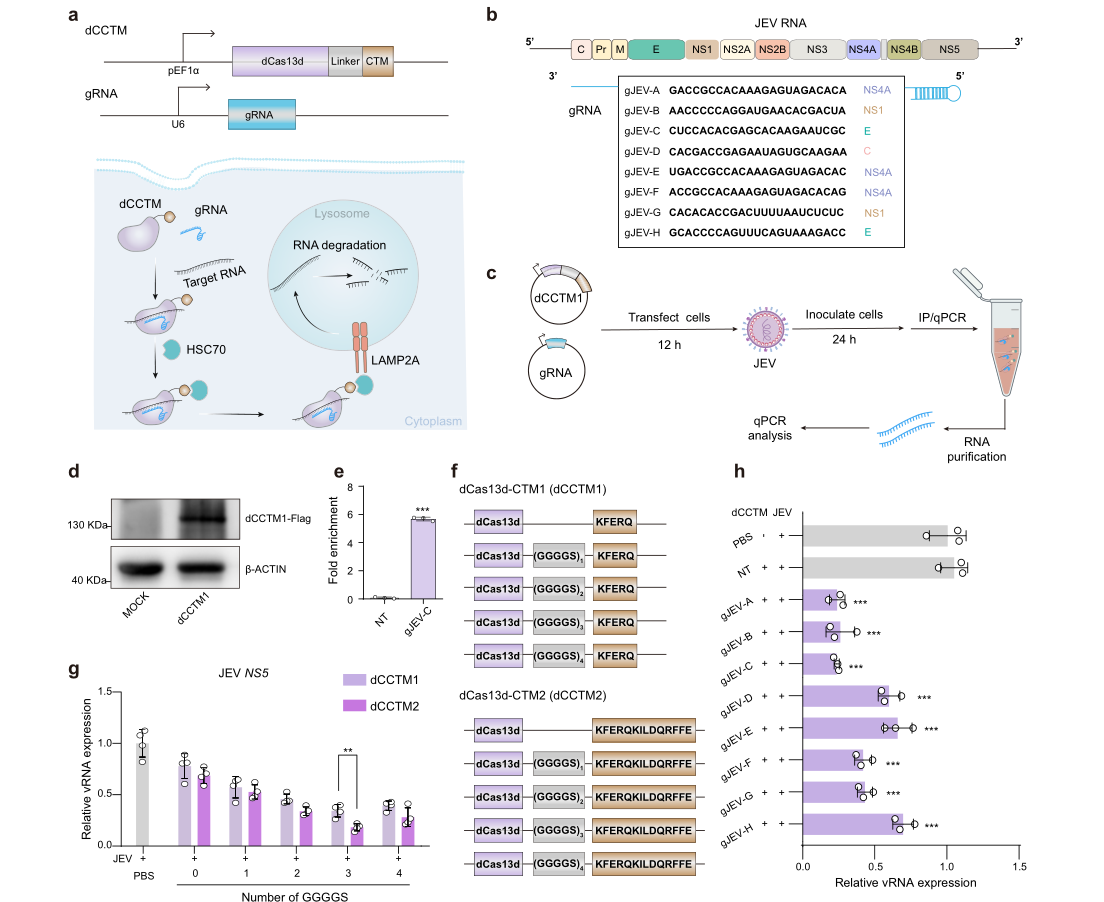
dCasCMA的核心设计思想极为巧妙。研究团队首先使用了催化失活的Cas13d(dCas13d)。这种“钝化”的Cas13d失去了切割RNA的能力,但保留了在向导RNA(gRNA)指引下,精准结合到目标RNA上的能力,就像一个精确制导的“锚”。
接着,他们在dCas13d蛋白上融合了一个特殊的“快递标签”——CMA靶向基序(CTM),如经典的KFERQ或其优化版本KFERQ-KILDQRFFE。这个标签是细胞内CMA通路的“通行证”。当dCas13d-gRNA复合物锚定到目标RNA上后,这个“快递标签”就会被细胞质中的热休克同源蛋白70(HSC70)识别。
一旦被识别,整个“dCas13d-目标RNA”复合物就会被当作“待回收垃圾”,通过溶酶体相关膜蛋白2A(LAMP2A)转运通道,被精准投递到溶酶体——细胞内的强效“消化车间”。在这里,目标RNA连同dCas13d一起被彻底降解。
这一策略的高明之处在于:它完全规避了Cas13的切割活性及其带来的脱靶风险,转而利用细胞自身高度选择性的CMA通路来完成最终的“处决”,实现了真正的“指哪打哪”。
从病毒到肿瘤:dCasCMA的广泛适用性验证
为了证明dCasCMA的强大威力,研究团队在多种疾病模型中进行了验证。
抗病毒应用: 他们以日本脑炎病毒(JEV)为模型。JEV是一种单链正链RNA病毒,对神经系统危害极大。研究人员设计了针对JEV基因组不同区域的gRNA,与dCasCMA系统共同作用。结果令人振奋:dCasCMA能高效、特异地降解JEV的病毒RNA(vRNA),显著降低病毒E蛋白的表达,并大幅抑制病毒在细胞和小鼠体内的复制。更关键的是,在感染的小鼠模型中,dCasCMA治疗显著减轻了脑部炎症损伤,展现了强大的体内治疗潜力。
肿瘤免疫治疗: 他们将目光转向了肿瘤免疫检查点PD-L1。PD-L1在肿瘤细胞表面高表达,会“麻痹”T细胞,帮助肿瘤逃避免疫攻击。研究团队设计了靶向Pd-l1 mRNA的gRNA,dCasCMA系统成功在结肠癌细胞中高效降解了Pd-l1 mRNA,其效果与成熟的siRNA疗法相当,且效果持久。更重要的是,PD-L1的下调有效抑制了与上皮-间质转化(EMT)相关的信号通路,显著削弱了肿瘤细胞的迁移能力。
多靶点协同打击: 针对病毒感染常伴随的“细胞因子风暴”,研究团队设计了一个包含多个gRNA的多重表达阵列(gJZS),可同时靶向JEV RNA、炎症关键因子ZBP1和STING的mRNA。实验表明,dCasCMA能同步降解这三个靶点,不仅强力抑制病毒,还显著降低了多种促炎因子(如TNF-α, IL-6)的水平,并提升了抗炎因子IL-10的表达,从而有效平息了过度的免疫反应,保护了宿主细胞。
超越现有技术:dCasCMA的独特优势
dCasCMA平台展现出多项超越现有RNA靶向技术的优势:
超高特异性与安全性: 由于不依赖核酸酶活性,从根本上杜绝了“旁观者切割”效应。研究通过RNA测序证实,dCasCMA的脱靶效应远低于野生型Cas13。
可编程性与模块化: 只需更换gRNA序列,即可轻松重定向至任何新的RNA靶点。其“dCCTM蛋白 + gRNA”的双组分设计,具有极高的灵活性和可扩展性。
高效的体内递送: 研究团队成功将dCCTM蛋白和gRNA装载到纳米脂质体(NLPs)中,通过脑室内注射,在小鼠体内实现了有效的靶向递送和治疗,证明了其临床转化的可行性。
内在的时空调控: 有趣的是,dCCTM蛋白自身也带有CMA标签,这意味着它在完成任务后也会被溶酶体降解。这种“自我清除”机制赋予了系统一个可预测的药代动力学特征,能在发挥疗效后自动衰减,避免了长期存在的潜在风险。
未来展望:通往RNA药物新世界的桥梁
dCasCMA的出现,为RNA靶向治疗领域开辟了一条全新的路径。它巧妙地将合成生物学工具(CRISPR)与细胞固有的生理通路(CMA)相结合,创造出一个既精准又安全的“智能导弹”系统。
尽管目前仍处于临床前研究阶段,但其在抗病毒、抗肿瘤、调控免疫乃至治疗由非编码RNA失调引起的疾病(如研究中提到的核富集lncRNA NEAT1)等方面展现出的巨大潜力,无疑令人充满期待。随着递送技术的进一步优化和更多靶点的验证,dCasCMA或其衍生平台有望成为下一代RNA药物开发的强大引擎,为攻克众多难治性疾病带来新的希望。