
在核酸药物迅速发展的当下,环状RNA(circular RNA, circRNA) 正逐步成为连接基础研究与应用转化的关键平台。《Molecular Therapy》近日发表的综述文章
《CircRNA: Unlocking New Frontiers in Therapeutic and Vaccine Development》系统梳理了circRNA技术在治疗性药物与疫苗研发领域的最新进展,阐明了其相
较于传统线性mRNA平台的独特优势与挑战,为下一代RNA技术的产业化提供了清晰方向。
一、mRNA之后的“第二代RNA平台”
mRNA疫苗的成功,标志着“可编程疫苗时代”的到来。然而,线性mRNA技术仍存在天然缺陷:分子不稳定、需超低温储运、剂量依赖性强且易引发先天免疫反
应。该综述指出,环状RNA有望成为下一代RNA药物形式(mRNA 2.0),其闭合环状结构可显著提升稳定性与蛋白表达持续时间,潜在地克服mRNA平台的多项限制。
文章指出,circRNA在以下方面展现出突出优势:
表达持续性更长:闭环结构避免外切核酸酶降解,使蛋白表达窗口显著延长;
制剂稳定性更高:储运条件更为宽松,冷链依赖度有望降低;
设计灵活性更强:可实现多价抗原、嵌合蛋白等复杂结构的一体化表达;
免疫反应可控:无需5′端加帽或poly(A)尾修饰,降低不必要的免疫激活风险。
这些特性意味着circRNA技术或将成为应对新发传染病、肿瘤疫苗与基因治疗的关键平台。
二、核心技术进展:从分子设计到递送体系
综述总结了当前circRNA技术的关键研发要点:
环化策略:主要包括核酶自切割法、内含子自拼接法、T4 RNA连接酶法及化学连接法。不同工艺在产率、杂质控制与可放大性方面差异明显。
翻译机制:circRNA缺乏5′端结构,通常依赖IRES(内含核糖体进入位点)或m6A介导的非典型起始机制(MIRES)实现翻译,这为蛋白合成提供了新的调控手段。
结构优化:UTR(非翻译区)、拼接“疤痕区”长度及序列构型显著影响翻译效率与稳定性;合理设计是高效表达的关键。
递送体系:目前仍以脂质纳米颗粒(LNP)为主,但文章指出,未来需要针对circRNA特性开发更精细的组织特异性递送平台。
纯化与质控:去除线性RNA残留、酶类杂质和双链RNA(dsRNA)污染,是制约工业化放大的主要挑战之一。
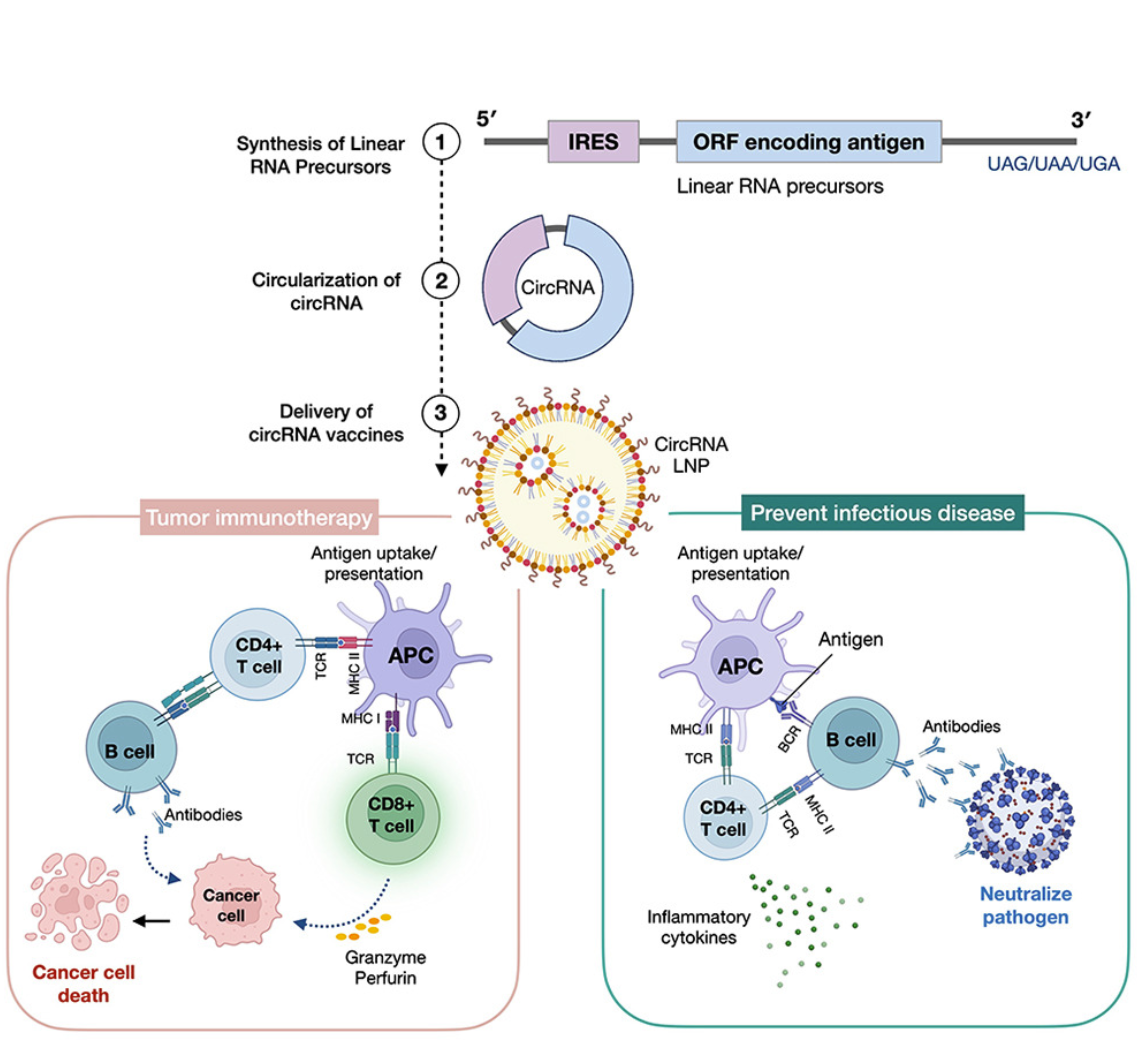
三、应用进展:从疫苗到治疗性RNA
目前,circRNA技术已在多个方向展现潜力:
疫苗领域:早期针对SARS-CoV-2的circRNA疫苗在动物模型中表现出高滴度抗体应答与持久的T细胞激活,部分指标优于同源mRNA疫苗。
多价与嵌合疫苗设计:circRNA可一次性表达多种抗原,为广谱或变异株疫苗研发提供新思路。
治疗性应用:包括circRNA编码治疗蛋白、CAR-T细胞改造、基因调控模板等方向,正在成为研究热点。
四、挑战与发展瓶颈
尽管circRNA展现出巨大潜能,文章亦指出其产业化仍面临多重挑战:
GMP规模化生产难度高:环化步骤及线性残留清除使工艺复杂度上升,目前多停留在实验室级别;
杂质与安全性风险:残留酶、dsRNA等杂质可能引发非特异免疫反应;
监管标准缺失:circRNA药物尚无成熟监管体系,质量控制指标和效价评价体系有待建立;
递送效率与组织靶向性:仍需开发适配circRNA的新型递送载体;
临床验证不足:需更多临床数据支持其长期有效性与安全性。
五、产业启示与未来展望
对企业与科研机构而言,circRNA技术既是机遇也是挑战:
平台价值高:掌握环化与纯化核心工艺的企业有望率先占领新一代疫苗与RNA药物高地;
差异化竞争潜力:相比mRNA,circRNA或能在稳定性、剂量节约与物流便利性上形成竞争优势;
协同合作趋势明显:学术与产业界需紧密协作,加速从概念验证到规模化生产的转化路径;
监管前置布局重要:及早参与circRNA标准制定,将有助于提升市场准入速度;
投资需理性:技术成熟与临床验证仍需时间,长期战略投入将决定领先优势。
六、结语
《Molecular Therapy》这篇综述的核心观点十分明确:环状RNA不再只是研究前沿的概念,而是即将走向临床与产业的现实平台。
凭借更高稳定性、可编程性与设计灵活性,circRNA有望成为继mRNA之后最具突破性的RNA药物技术之一。
但要真正实现商业化与临床成功,仍需在生产、递送、质控与监管等环节进行系统性创新与验证。
从“mRNA时代”迈向“circRNA时代”,核酸药物的演进正在重塑全球生物医药版图。